题目内容
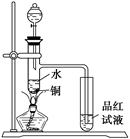
如图,在试管甲中先加入2 mL 95%的乙醇,并在摇动下缓慢加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水乙酸钠(CH3COONa).将试管甲固定在铁架台上,在试管乙中加入5 mL饱和碳酸钠溶液,按下图连接好装置进行实验,当试管乙中有明显现象时停止实验.

试回答:
(1)实验时,应对试管甲缓慢加热,其目的是________.
(2)写出试管甲中发生反应的化学方程式:________.
(3)加入浓硫酸的作用是________、________、________.
(4)该实验中球形管丙的作用是________.
(5)某同学做此实验时,观察到反应混合液变黑,并闻到刺激性气味,试分析其原因:________.
答案:
解析:
解析:
|
答案:(1)减少乙醇、乙酸的挥发,减少副反应的发生 (2)CH3COONa+H2SO4 CH3COOH+CH3CH2OH 或CH3COONa+H2SO4+CH3CH2OH (3)反应物(或制取乙酸) 催化剂 吸水剂 (4)防止倒吸 (5)加热温度过高使有机物脱水有碳生成,浓硫酸被还原为SO2 解析:本题是实验室制取乙酸乙酯的实验,实验中的乙酸是由乙酸钠和硫酸反应产生的;实验中使用了干燥管来防止倒吸,若不使用干燥管只用导管,导管末端就不能插入饱和碳酸钠溶液中. |

练习册系列答案
相关题目
 下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证: