题目内容
如图所示,容器中间是一个可左右滑动的隔板,若容器材料的导热性很好,能保持容器左、右侧温度一致。起始时向左侧的容器中加入1 mol N2、3 mol H2,右侧容器中加入2 mol A2、2 mol B2进行反应,达到平衡。下列说法正确的是

[ ]
A.平衡时隔板仍在正中间
B.左侧反应的反应速率一定小于右侧反应的反应速率
C.当达到平衡时,若升温隔板一定会发生移动
D.若人为地将隔板向右推动,由于右侧平衡不受压强影响,故隔板可停留在所推动的位置上
B.左侧反应的反应速率一定小于右侧反应的反应速率
C.当达到平衡时,若升温隔板一定会发生移动
D.若人为地将隔板向右推动,由于右侧平衡不受压强影响,故隔板可停留在所推动的位置上
C

练习册系列答案
相关题目
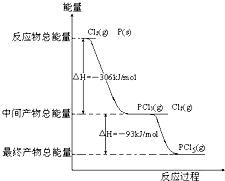 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据) 如图所示,保持反应过程中温度不变,在一个容积为4L的密闭容器中,左室加入X molSO3,右室加入2 molSO2和1molO2,中间是个可移动的隔板,在少量催化剂存在下分别发生反应:
如图所示,保持反应过程中温度不变,在一个容积为4L的密闭容器中,左室加入X molSO3,右室加入2 molSO2和1molO2,中间是个可移动的隔板,在少量催化剂存在下分别发生反应: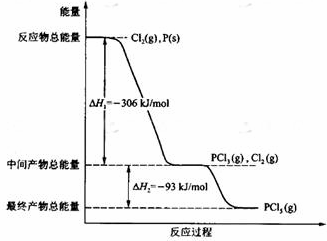 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题: 如图所示,容积固定的密闭容器用可自由滑动的活塞分开,在相同的温度下,左右两边各充入一定量的H2和O2,且恰好使活塞处于正中间,则下列结论不正确的是( )
如图所示,容积固定的密闭容器用可自由滑动的活塞分开,在相同的温度下,左右两边各充入一定量的H2和O2,且恰好使活塞处于正中间,则下列结论不正确的是( )