题目内容
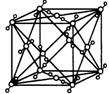
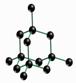
如图所示是一些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分.科(1)下列判断正确的是

A.B表示金刚石、D表示石墨 B.D表示石墨、E表示干冰C.A表示CsCl、E表示NaCl、C表示干冰
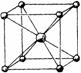
(2)NaCl晶体中每个钠离子周围与它最接近且距离相等的钠离子有
(3)CsCl晶体中,每个铯离子与
(4)干冰晶体中含有的微粒间作用力有
A.离子键 B.共价键 C.氢键 D.分子间作用力 E.配位键
(5)A-E晶体中,固体可以导电的是
A
A
(填序号)
A.B表示金刚石、D表示石墨 B.D表示石墨、E表示干冰C.A表示CsCl、E表示NaCl、C表示干冰
(2)NaCl晶体中每个钠离子周围与它最接近且距离相等的钠离子有
12
12
个,每个NaCl晶胞中平均含有4
4
个Na+和4
4
个Cl-(3)CsCl晶体中,每个铯离子与
8
8
个氯离子紧邻.(4)干冰晶体中含有的微粒间作用力有
BD
BD
(填序号)A.离子键 B.共价键 C.氢键 D.分子间作用力 E.配位键
(5)A-E晶体中,固体可以导电的是
石墨
石墨
(填物质名称),固态不能导电但熔融状态或水溶液可以导电是氯化钠和氯化铯
氯化钠和氯化铯
(填物质名称).分析:(1)根据晶体构成微粒及结构、晶体类型判断;
(2)NaCl晶体中每个钠离子周围与它最接近且距离相等的钠离子有12个,利用均摊法计算;
(3)CsCl晶体中,铯离子的配位数是8;
(4)干冰属于分子晶体,其构成微粒是分子,干冰中原子间存在共价键,分子间存在分子间作用力;
(5)金属单质、石墨、熔融态电解质在固体时能导电,固态不能导电但熔融状态或水溶液可以导电的是电解质.
(2)NaCl晶体中每个钠离子周围与它最接近且距离相等的钠离子有12个,利用均摊法计算;
(3)CsCl晶体中,铯离子的配位数是8;
(4)干冰属于分子晶体,其构成微粒是分子,干冰中原子间存在共价键,分子间存在分子间作用力;
(5)金属单质、石墨、熔融态电解质在固体时能导电,固态不能导电但熔融状态或水溶液可以导电的是电解质.
解答:解:(1)氯化钠是离子晶体,其构成微粒是阴阳离子,钠离子的配位数是6,所以A是氯化钠晶体;金刚石属于原子晶体,其空间构型是空间网状结构,B是金刚石;
C构成微粒是分子,属于分子晶体,干冰属于分子晶体,所以C是干冰;
D是石墨,石墨是层状结构;
E是氯化铯晶体,其配位数是8;
A.B表示金刚石、D表示石墨,故正确;
B.D表示石墨、E表示氯化铯,故错误;
C.A表示氯化钠、E表示氯化铯、C表示干冰,故错误;
故选A.
(2)NaCl晶体中每个钠离子周围与它最接近且距离相等的钠离子=3×8×
=12,每个晶胞中钠离子个数=8×
+6×
=4,氯离子个数=1+12×
=4,
故答案为:12,4,4;
(3)根据图片知,CsCl晶体中,每个铯离子与8个氯离子紧邻,故答案为:8;
(4)干冰属于分子晶体,其构成微粒是分子,干冰中碳原子和氧原子间存在共价键,分子间存在分子间作用力,故选BD;
(5)固体石墨能导电,固态不能导电但熔融状态或水溶液可以导电的是氯化钠和氯化铯,
故答案为:石墨,氯化钠和氯化铯.
C构成微粒是分子,属于分子晶体,干冰属于分子晶体,所以C是干冰;
D是石墨,石墨是层状结构;
E是氯化铯晶体,其配位数是8;
A.B表示金刚石、D表示石墨,故正确;
B.D表示石墨、E表示氯化铯,故错误;
C.A表示氯化钠、E表示氯化铯、C表示干冰,故错误;
故选A.
(2)NaCl晶体中每个钠离子周围与它最接近且距离相等的钠离子=3×8×
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 4 |
故答案为:12,4,4;
(3)根据图片知,CsCl晶体中,每个铯离子与8个氯离子紧邻,故答案为:8;
(4)干冰属于分子晶体,其构成微粒是分子,干冰中碳原子和氧原子间存在共价键,分子间存在分子间作用力,故选BD;
(5)固体石墨能导电,固态不能导电但熔融状态或水溶液可以导电的是氯化钠和氯化铯,
故答案为:石墨,氯化钠和氯化铯.
点评:本题考查了典型的晶体结构,明确晶体的构成微粒及结构是解本题关键,难点是计算离子的配位数.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目