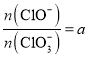题目内容
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
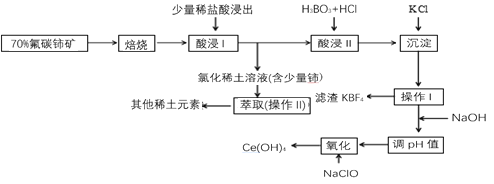
已知:
i.铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液。
ii.酸浸II中发生反应:9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是_______。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。少量铈进入稀土溶液发生反应的离子方程式是________。
(3)向Ce(BF4)3中加入KCl溶液的目的是______。
(4)操作I的名称为_______,在实验室中进行操作II时所需要的硅酸盐仪器有_______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的pH应大于________即可认为Ce3+已完全沉淀。(已知:Ksp[Ce(OH)3]=1.0×10-20)
(6)取上述流程中得到的Ce(OH)4产品5.000g,加酸溶解后,向其中加入含0.03300mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.1000mol·L-1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则该产品中Ce(OH)4的质量分数为______(已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208,保留3位有效数字)。
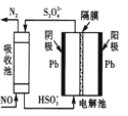
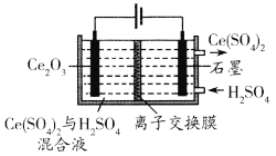
(7)利用电解方法也可以实现铈的回收。在酸性条件下电解Ce2O3(如图),离子交换膜为____(填“阴”或“阳”)离子交换膜。
【答案】将铈氧化为四价便于与其他稀土元素分离 2xCO+CeO2=CeO2(1-x)+2xCO2 8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O 避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率) 过滤 烧杯、分液漏斗 9 95.7% 阳
【解析】
(1)①题中已经告知焙烧之后,铈元素转化成CeO2和CeF4,且四价铈不易进入溶液,则焙烧的目的是将铈元素转化为+4价的化合物,从而通过溶解的方法获得更为纯净的铈的化合物;
②将反应2CO+O2=2CO2和题中反应相加,可得:2xCO+CeO2=CeO2(1-x)+2xCO2;
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体,说明HCl被氧化为Cl2,则该反应的离子方程式为8H++2Cl-+2CeO2=2Ce3++Cl2↑+4H2O;
(3)酸浸II得到Ce(BF4)3沉淀,加入KCl溶液,得到KBF4沉淀,则说明沉淀发生了转化,并生成了CeCl3,由于CeCl3才是该步的目标产物,且后学操作又需要将CeCl3转化为Ce(OH)3,这些操作都是在溶液中进行,所以这步沉淀转化的目的是避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率);
(4)经过操作I得到滤渣和溶液,则操作I为过滤;操作II为萃取,则需要使用的硅酸盐仪器(即玻璃仪器)为烧杯、分液漏斗;
(5)Ce3+完全沉淀时,c(Ce3+)≤1.0×10-5mol·L-1;由于Ksp[Ce(OH)3]= c(Ce3+)·c3(OH-)=1.0×10-20,解得c(OH-)=1.0×10-5mol·L-1,则pH=9;
(6)n(KMnO4)=0.1 mol·L-1×0.02L=0.002mol,
根据得失电子守恒,可知:
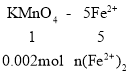
则n(Fe2+)2=0.01mol,所以n(Fe2+)1= n(Fe2+)-n(Fe2+)2=0.033mol-0.01mol=0.023mol,
又有: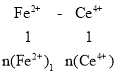 ,则n[Ce(OH)4]= n(Ce 4+)= n(Fe2+)1=0.023mol,
,则n[Ce(OH)4]= n(Ce 4+)= n(Fe2+)1=0.023mol,
所以,w[Ce(OH)4]=![]() ×100%=
×100%=![]() ×100%=95.7%;
×100%=95.7%;
(7)观察电极可知,阳极Ce2O3放电,生成Ce4+,并在阴极形成产物Ce(SO4)2,则离子交换膜为阳离子交换膜。