题目内容
18.用电子式表示下列物质的结构:(1)Ca(OH)2

(2)CO2

(3)H2O2

(4)MgO

(5)Na2O2
 .
.
分析 (1)Ca(OH)2是离子化合物,由Ca2+离子和OH-离子构成;
(2)二氧化碳中存在两对碳氧共用电子对;
(3)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键;
(4)氧化镁为离子化合物,必须标出阴阳离子的电子式;
(5)Na2O2是离子化合物,由Na+离子和O2-离子构成.
解答 解:(1)Ca(OH)2是离子化合物,由Ca2+离子和OH-离子构成,Ca(OH)2的电子式为 ,
,
故答案为: ;
;
(2)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,故答案为:
,故答案为: ;
;
(3)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:
,故答案为: ;
;
(4) ,故答案为:
,故答案为: ;
;
(5)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为: ,
,
故答案为: .
.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
相关题目
8.将Cu、Zn混合物投入稀HNO3中,充分反应后,锌有剩余,则反应后的肯定不存在的是
①Cu ②Cu(NO3)2 ③HNO3 ④Zn(NO3)2( )
①Cu ②Cu(NO3)2 ③HNO3 ④Zn(NO3)2( )
| A. | ①和② | B. | ②和③ | C. | ①和③ | D. | ②和④ |
3.下列关于元素周期律的叙述正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 主族元素原子的最高正价和负价的绝对值之和一定是8 |
10.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n为正整数)( )
| A. | 若R(OH)n为强碱,则W(OH)m也为强碱 | |
| B. | 若HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
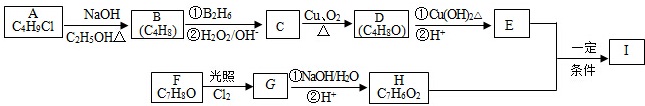
 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$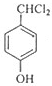 +2HCl,该反应类型为取代反应.
+2HCl,该反应类型为取代反应. .
. .
.
 ;
;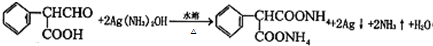 .
.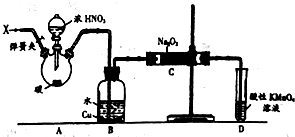 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和铜为原料制备硝酸钠的装置如图所示.