题目内容
8.硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下:
请回答下列问题:
(1)确定锌镀层被除去的标志是反应速率突然减小(或铁片表面生成的气泡突然减少);
计算上述铁片锌镀层的厚度,不需要的数据是e(填编号).
a.锌的密度ρ(g/cm3) b.镀锌铁片质量m1(g) c.纯铁片质量m2(g)d.镀锌铁片面积S(cm2) e.镀锌铁片厚度h(cm)
(2)上述流程中:操作Ⅰ是取出铁片、洗涤、烘干、称量.
(3)A物质可以为bd(填编号).
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(4)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是避免加热过程中晶体受热分解失去结晶水或被空气氧化.
(5)鉴定所得晶体中含有Fe2+、NH4+、SO42-离子的实验方法正确的是b、c、d(填编号).
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象.
分析 (1)根据锌比铁活泼,锌与盐酸反应比铁与盐酸反应速率快;根据实验的原理是利用锌的质量、密度求出锌的体积,再利用锌的体积除以锌的面积即得锌镀层的厚度;
(2)根据过滤操作的步骤:过滤、洗涤、烘干等来分析;
(3)加入的物质或与稀硫酸反应后的物质能与铁反应且不引进新的杂质离子;
(4)硫酸亚铁铵晶体受热易分解且易被氧化;
(5)根据Fe2+的检验方法:取少量样品于试管中,加入硫氰酸钾溶液无现象,加入氯水溶液变为血红色或加入NaOH溶液,先产生白色沉淀,然后变成灰绿色最终变成红褐色;
NH4+的检验方法:取少量样品于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,试纸变蓝;
SO42-的检验方法:取少量样品于试管,先加入盐酸后无现象,再加入BaCl2溶液,产生白色沉淀.
解答 解:(1)锌比铁活泼,锌与盐酸反应比铁与盐酸反应速率快,所以确定锌镀层被除去的标志是反应速率突然减小(或铁片表面生成的气泡突然减少);实验的原理:利用锌的质量、密度求出锌的体积,再利用锌的体积除以锌的面积即得锌镀层的厚度,锌的质量=镀锌铁片质量-纯铁片质量,所以不需要的数据是镀锌铁片厚度;
故答案为:反应速率突然减小(或铁片表面生成的气泡突然减少);e;
(2)过滤操作的步骤有:过滤、洗涤、烘干,所以操作Ⅰ是取出铁片、洗涤、烘干、称量,
故答案为:洗涤、烘干;
(3)加入的物质或与稀硫酸反应后的物质能与铁反应且不引进新的杂质离子,ac能引进新的杂质离子,bd不能引进新的杂质离子,
故选bd;
(4)如果采用加热的方法制取硫酸亚铁铵,加热过程中,硫酸亚铁铵易失水,且亚铁离子易被氧气氧化,从而得不到硫酸亚铁铵晶体;
故答案为:避免加热过程中晶体受热分解失去结晶水或被空气氧化;
(5)a.Fe2+的检验方法:取少量样品于试管中,加入硫氰酸钾溶液无现象,加入氯水溶液变为血红色,故a错误;
b.Fe2+的检验方法:取少量样品于试管中,加入NaOH溶液,先产生白色沉淀,然后变成灰绿色最终变成红褐色,故b正确;
c.NH4+的检验方法:取少量样品于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,试纸变蓝,故c正确;
d.SO42-的检验方法:取少量样品于试管,先加入盐酸后无现象,再加入BaCl2溶液,产生白色沉淀,故d正确;
故选:b、c、d.
点评 本题主要考查了物质的除杂与制备,涉及到物质的性质、离子的检验,氧化还原反应方程式的书写以及滴定实验等方面的综合知识,要求学生具有分析和解决问题的能力,难度较大.

 阅读快车系列答案
阅读快车系列答案①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检验装置气密性后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撤酒精灯待试管冷却后停止通H2
⑥量筒用蒸馏水洗涤后再使用
⑦组装仪器的顺序是先下后上,先左后右.
| A. | ①②③⑤⑦ | B. | ①②④⑤⑥ | C. | ①②③④⑤ | D. | 全部 |
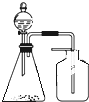
| A. | FeS与稀硫酸 | B. | 铜与浓硫酸 | C. | 稀硝酸与铜片 | D. | 电石与水 |
| A. | 127R-的核外含有53电子 | |
| B. | Y、Z、R的氢化物的稳定性逐渐减弱 | |
| C. | Z的单质易挥发,可以水封保存 | |
| D. | 在含有Z单质的水溶液中,通入足量XO2气体,则溶液由黄色变为无色 |

已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑;③Cr2O72-+H2O 2CrO42-+2H+
根据题意回答下列问题:
(1)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(2)酸化步骤用醋酸调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸(填写仪器或试剂名称).如表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
(4)该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使沉淀质量达到最大值:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 钠与水的反应:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| A. | Na+、Fe2+、NO3-、Cl- | B. | Ca2+、K+、Cl-、NO3- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |

