题目内容
【题目】一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下.请回答下列问题: 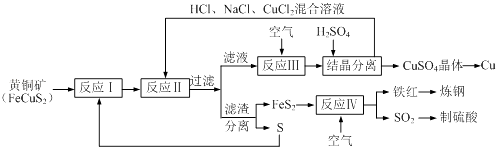
(1)反应Ⅲ的离子方程式为4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O,CuCl2﹣中铜元素的化合价为 , 该反应中的氧化剂是 .
(2)一定温度下,在反应Ⅲ所得的溶液中加入硫酸,可以析出硫酸铜晶体而不析出氯化铜晶体,其原因可能是 .
(3)炼钢时,可将铁红投入熔融的生铁中,以降低生铁的含碳量,该过程中主要反应的化学方程式是 .
(4)SO2尾气直接排放到大气中造成环境污染的后果是 .
(5)已知反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣═2CuCl2﹣+S,反应Ⅰ的产物为和 . (填化学式)
【答案】
(1)+1;O2
(2)该温度下,硫酸铜的溶解度小于氯化铜、加入硫酸,有利于析出硫酸铜晶体
(3)3C+Fe2O3 ![]() 2Fe+3CO↑
2Fe+3CO↑
(4)形成酸雨
(5)FeS2;CuS
【解析】解:铜矿与S在高温下煅烧,使其转变为FeS2、CuS,加入HCl、NaCl、CuCl2混合溶液 发生反应Cu2++CuS+4Cl﹣=2[CuCl2]﹣+S↓,过滤得到滤液中通入空气发生反应4CuCl2﹣+O2+4H+=4Cu2++8Cl﹣+2H2O,一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,结晶分离得到硫酸铜晶体,加入铁还原溶液得到铜;滤渣分离得到FeS和S,FeS2通入空气灼烧得到氧化铁和二氧化硫,氧化铁炼钢,二氧化硫制备硫酸,(1)CuCl2﹣中氯离子的化合价为﹣1价,2个氯离子为﹣2价,则铜元素的化合价为+1价;
反应4CuCl2﹣+O2+4H+═4Cu2++8Cl﹣+2H2O中,O2得到电子被还原,则O2为氧化剂,所以答案是:+1;O2;(2)相同条件下硫酸铜的溶解度小,则该温度下,硫酸铜的溶解度小于氯化铜,所以向反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,所以答案是:该温度下,硫酸铜的溶解度小于氯化铜、加入硫酸,有利于析出硫酸铜晶体;(3)炼钢时,可将铁红投入熔融的生铁中,滤液碳和氧化铁反应生成铁和一氧化碳,反应的化学方程式为:3C+Fe2O3 ![]() 2Fe+3CO↑,所以答案是:3C+Fe2O3
2Fe+3CO↑,所以答案是:3C+Fe2O3 ![]() 2Fe+3CO↑;(4)SO2尾气直接排放到大气中,二氧化硫溶于水形成亚硫酸,而亚硫酸容易被空气中氧气氧化成硫酸,导致雨水酸性增强,易形成酸雨,所以答案是:形成酸雨;(5)反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣═2CuCl2﹣+S,结合流程可知,黄铁矿分解生成的Fe、Cu均为+2价,则反应I的产物为:FeS2、CuS,所以答案是:FeS2;CuS.
2Fe+3CO↑;(4)SO2尾气直接排放到大气中,二氧化硫溶于水形成亚硫酸,而亚硫酸容易被空气中氧气氧化成硫酸,导致雨水酸性增强,易形成酸雨,所以答案是:形成酸雨;(5)反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣═2CuCl2﹣+S,结合流程可知,黄铁矿分解生成的Fe、Cu均为+2价,则反应I的产物为:FeS2、CuS,所以答案是:FeS2;CuS.

【题目】某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH |
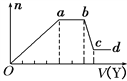
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则溶液中含有的阳离子是______ ,ab段发生反应的总离子方程式为____________, Oa段上表中参加反应的离子的物质的量之比为________________________。
[要标明离子符号,如n(Fe3+)].
(2)若Y是NaOH溶液,则X中一定含有上表中的离子是________________________,它们的离子个数比为______________________________,[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列].ab段反应的离子方程式为______________________________, bc段反应的离子方程式为____________________________________。
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的是( )
选项 | 实验目的 | 实验仪器或装置 |
A | 除去KCl中少的 MnO2 | 烧杯、玻璃棒、分液漏斗 |
B | 用10mol/L的盐酸配制100mL0.1mol/L的盐酸 | 100mL容量瓶、玻璃棒、烧杯 |
C | 用氯化钠溶液制备氯化钠晶体 |
|
D | 用右图装置验证SO2的漂白性 |
|
A. A B. B C. C D. D

