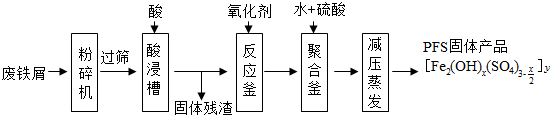
题目内容
12.298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )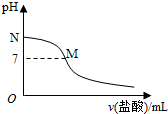
| A. | 该滴定过程应该选择酚酞作为指示剂 | |
| B. | M点对应的盐酸体积为20.0mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<12 |
分析 A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,所以应选择甲基橙作指示剂;
B.如果M点盐酸体积为20.0mL,则二者恰好完全反应生成氯化铵,溶液应该呈酸性;
C.M处溶液呈中性,则存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制;
D.N点为氨水溶液,氨水浓度为0.10mol•L-1,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol/L×1.32%=1.32×10-3 mol/L,c(H+)=$\frac{1{0}^{-14}}{1.32×1{0}^{-3}}$mol/L=7.6×10-12mol/L.
解答 解:A.强酸弱碱相互滴定时,由于生成强酸弱碱盐使溶液显酸性,所以应选择甲基橙作指示剂,所以盐酸滴定氨水需要甲基橙作指示剂,故A错误;
B.如果M点盐酸体积为20.0mL,则二者恰好完全反应生成氯化铵,氯化铵中铵根离子水解导致该点溶液应该呈酸性,要使溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于20.0mL,故B错误;
C.M处溶液呈中性,则存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(Cl-),该点溶液中溶质为氯化铵和一水合氨,铵根离子水解而促进水电离、一水合氨抑制水电离,铵根离子水解和一水合氨电离相互抑制,水的电离程度很小,该点溶液中离子浓度大小顺序是c(NH4+)=c(Cl-)>c(H+)=c(OH-),故C错误;
D.N点为氨水溶液,氨水浓度为0.10mol•L-1,该氨水电离度为1.32%,则该溶液中c(OH-)=0.10mol/L×1.32%=1.32×10-3 mol/L,c(H+)=$\frac{1{0}^{-14}}{1.32×1{0}^{-3}}$mol/L=7.6×10-12mol/L,所以该点溶液pH<12,故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生实验操作、试剂选取、识图及分析判断能力,明确实验操作、盐类水解、弱电解质的电离等知识点是解本题关键,注意B采用逆向思维方法分析解答,知道酸碱中和滴定中指示剂的选取方法,题目难度中等.

(1)配制FeSO4溶液时需要加入少量稀硫酸的目的是抑制FeSO4的水解,判断FeSO4溶液是否变质的方法是取适量FeSO4溶液于试管中,向溶液中加入KSCN溶液,若溶液变红,则说明FeSO4溶液变质,无现象则不变质.
(2)实验室通常向FeSO4溶液中加入饱和(NH4)2SO4溶液,然后经过“一系列操作”后得到硫酸亚铁铵晶体,其中“一系列操作”依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)为了洗涤硫酸亚铁铵晶体的粗产品,下列方法中最合适的是d(填字母).
a.用冷水洗 b.先用冷水洗,后用无水乙醇洗
c.用Na2SO4熔液洗 d.用无水乙醇洗
(4)为了测定硫酸亚铁晶体产品的纯度,称取ag产品溶于水,配制成500mL溶液,取待测液25.00mL
用浓度为cmol•L-1的酸性KMnO4溶液滴定.重复上述操作2次,实验结果如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液的体积/ml | 25.52 | 25.02 | 24.98 |
②滴定终点的现象是最后一滴滴入,溶液由无色变为浅紫色,且30s不变色,.
③该产品的纯度为$\frac{980c}{a}$×100%(用含a、c的代数式表示).
④上表中第一次实验记录的数据明显大于后两次,其原因可能是bc(填字母).
a.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
b.滴定前滴定管尖嘴有气泡,滴定结束无气泡
c.第一次滴定用的锥形瓶用待装液润洗过,后两次来润洗
d.该酸性高锰酸钾标准液未用硫酸酸化,改用硝酸酸化.
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | B. | 元素的非金属性Z>X>Y | ||
| C. | Y的氢化物常温常压下为液态 | D. | X的最高价氧化物的水化物为强酸 |
| 实验目的 | 实验操作 | |
| A. | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B. | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C. | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D. | 比较水与乙醇中氢的活泼性 | 分别将少量钠投入到盛有水和乙醇的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 徐光宪建立稀土串级萃取理论 | B. | 屠呦呦发现抗疟新药青蒿素 | ||
| C. | 闵恩泽研发重油裂解催化剂 | D. | 侯德榜联合制碱法 |
(1)NaClO2的化学名称为亚氯酸钠.
(2)在鼓泡反应器中通入含SO2、NOx的烟气,反应温度323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表.
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”、“不变”或“减小”).
③由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)原因是除了SO2和NO在烟气中初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压Pe如图所示.
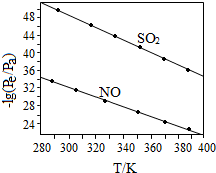
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均减小(填“增大”、“不变”或“减小”).
②反应ClO2-+2SO32-═2SO42-+Cl-的平衡常数K表达式为$\frac{c(C{l}^{-}){c}^{2}(S{{O}_{4}}^{2-})}{c(Cl{{O}_{2}}^{-}){c}^{2}(S{{O}_{3}}^{2-})}$.
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高.
②已知下列反应:
SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)═CaSO4(s)+H2O(l)+Cl-(aq)的△H=△H1+△H2-△H3.
| A. | KOH | B. | KNO3 | C. | NH4HCO3 | D. | 酒精 |