题目内容
【题目】用下列实验装置进行相应实验,能达到实验目的的是
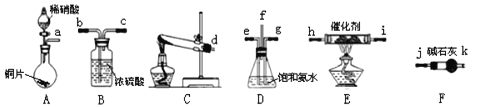
A.用图1所示装置可收集NO气体
B.用图4装置可证明酸性:H2SO4>H2CO3>H2SiO3
C.用图3所示装置可实现反应:2H2O![]() O2↑+2H2↑
O2↑+2H2↑
D.用图2所示装置可吸收多余氨气且能防止倒吸
【答案】B
【解析】
A.NO易与空气中的氧气发生反应生成二氧化氮,故不能用排空气法收集,故A不能达到实验目;
B.图4,先用稀硫酸与碳酸钠反应制备二氧化碳,再将二氧化碳通入硅酸钠溶液,有白色胶状沉淀生成,故可以证明酸性由强到弱的顺序为H2SO4>H2CO3>H2SiO3 ,故B能达到实验目;
C.电源正极连接的阳极,阳极失电子,金属铜失去电子,发生氧化还原反应,总反应为Cu+2H2O![]() Cu(OH)2+H2↑,故C不能达到实验目;
Cu(OH)2+H2↑,故C不能达到实验目;
D.氨气能被稀硫酸吸收,但容易发生倒吸,若将苯换为四氯化碳可达目的,故D不能达到实验目。
此题选B。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】![]() 时.体积均为
时.体积均为![]() 的两个恒容密闭容器中发生可逆反应:
的两个恒容密闭容器中发生可逆反应:![]()
![]() 实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是
实验测得反应在起始、达到平衡时的有关数据如表,下列叙述正确的是![]()
容器编号 | 起始时各物质物质的量 | 达到平衡时体系能量的变化 | ||
A | B | C | ||
| 2 | 1 | 0 |
|
|
|
|
| |
A.容器![]() 、
、![]() 中的平衡常数均为36
中的平衡常数均为36
B.向容器![]() 中通入氦气,平衡时A的转化率不变
中通入氦气,平衡时A的转化率不变
C.容器![]() 中达到平衡时放出的热量为/span>
中达到平衡时放出的热量为/span>![]() QkJ,达到平衡时,两个容器中C的物质的量浓度均为
QkJ,达到平衡时,两个容器中C的物质的量浓度均为![]()
![]()
D.其他条件不变,若容器![]() 保持恒容绝热,则达到平衡时C的体积分数小于
保持恒容绝热,则达到平衡时C的体积分数小于![]()
【题目】在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物![]() 如图所示
如图所示![]() ,发生反应:
,发生反应:![]() 保持温度不变,测得平衡时的有关数据如下:
保持温度不变,测得平衡时的有关数据如下:
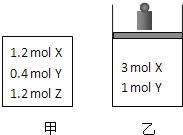
恒容容器甲 | 恒压容器乙 | |
Y的物质的量 |
|
|
Z的体积分数 |
|
|
下列说法正确的是![]()
A.平衡时容器乙的容积一定比反应前小
B.![]()
C.![]()
D.平衡时容器甲的压强一定比反应前大
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.已知氢气有多种制取方法:
①活泼金属![]() 如钠、钾
如钠、钾![]() 直接跟水反应;
直接跟水反应;
②金属![]() 如锌或铁或铝
如锌或铁或铝![]() 跟稀盐酸或稀硫酸反应;
跟稀盐酸或稀硫酸反应;
③电解水制氢气;
④由煤或焦炭跟水反应制取氢气:![]()
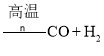 ;
;
⑤由天然气或重油制取氢气:![]()

![]() ;
;
(1)请你再补充一种制取氢气的方法,写出该反应的化学方程式 ______ .
(2)比较方法①和⑤: ______ g金属钠跟水反应与标准状况下![]()
![]() 跟水反应产生氢气的量相等.
跟水反应产生氢气的量相等.
(3)在甲、乙、丙3个容积均为2L的密闭容器中,于相同的温度下、使用相同的催化剂分别进行如下反应: 3H2(g)+N2(g) ![]() 2NH3(g),现按不同配比投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),现按不同配比投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 |
|
|
|
达到平衡的时间 |
| 5 | 8 |
| c |
| c |
|
|
|
|
混合气体密度 |
|
|
|
①分析表数据,下列关系正确的是 ______ ![]() 填写序号字母
填写序号字母![]() .
.
A.![]()
![]()
![]()
②在该温度下该反应的平衡常数![]() ______
______ ![]() 用含
用含![]() 的代数式表示
的代数式表示![]() .
.
(4)已知:![]() ;
;![]()
![]() ;
;![]()
则甲烷和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式为 ______ .
的热化学方程式为 ______ .
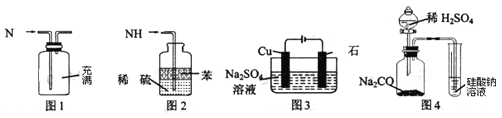
(5)如图所示装置工作时均与![]() 有关.
有关.
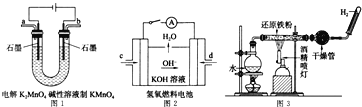
①图1所示装置中阳极的电极反应式为 ______ .
②图2所示装置中,通入![]() 的管口是 ______
的管口是 ______ ![]() 选填字母代号
选填字母代号![]() .
.
③某同学按图3所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和![]() 该结论 ______
该结论 ______ ![]() 填“严密”或“不严密”
填“严密”或“不严密”![]() ,你的理由是 ______
,你的理由是 ______ ![]() 用离子方程式表示
用离子方程式表示![]() .
.
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:![]() 三氯化氮
三氯化氮![]() 是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量
是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量![]() ,而在阴极区与生成的氯气反应产生少量
,而在阴极区与生成的氯气反应产生少量![]() ,该反应的化学方程式为______。
,该反应的化学方程式为______。![]() 一定条件下,不同物质的量的
一定条件下,不同物质的量的![]() 与不同体积的
与不同体积的![]() 溶液充分反应放出的热量如下表所示:
溶液充分反应放出的热量如下表所示:
反应序号 | n | V | 放出的热量 |
1 |
|
| A |
2 |
|
| b |
该条件![]() 与NaOH 溶液反应生成
与NaOH 溶液反应生成![]() 的热化学反应方程式为______。
的热化学反应方程式为______。![]() 利用CO可以将NO转化为无害的
利用CO可以将NO转化为无害的 ,其反应为:
,其反应为:![]() ,向容积均为1L的甲,乙两个恒温
,向容积均为1L的甲,乙两个恒温![]() 温度分别为
温度分别为![]() 、
、![]() 容器中分别加入
容器中分别加入![]() 和
和![]() ,测得各容器中
,测得各容器中![]() 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
| 0 | 40 | 80 | 120 | 160 |
|
|
|
|
|
|
|
|
|
|
|
|
![]() 甲容器中,
甲容器中,![]() 内用NO的浓度变化表示的反应速率
内用NO的浓度变化表示的反应速率![]() ______。
______。![]() 该反应的
该反应的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。![]() 甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______
甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移动。
移动。![]() 常温下,在
常温下,在![]() 溶液中,反应
溶液中,反应![]() 的平衡常数
的平衡常数![]() ______。
______。![]() 已知常温下,
已知常温下,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]()
![]() 在酸性电解质溶液中,以惰性材料作电极,将
在酸性电解质溶液中,以惰性材料作电极,将![]() 转化为丙烯的原理如图所示
转化为丙烯的原理如图所示
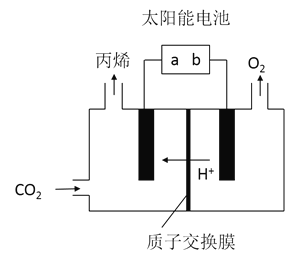
![]() 太阳能电池的负极是______
太阳能电池的负极是______![]() 填“a”或“b”
填“a”或“b”![]()
![]() 生成丙烯的电极反应式是______。
生成丙烯的电极反应式是______。