题目内容
17.下列关于漂白粉的叙述不正确的是( )| A. | 漂白粉的有效成分是Ca(ClO)2 | B. | 漂白粉暴露在空气中久置后能变质 | ||
| C. | 漂白粉是由Cl2与石灰乳制得 | D. | 在使用漂白粉时应用浓盐酸 |
分析 工业用氯气和石灰乳反应制备漂白粉,漂白粉的主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙;且HClO具有漂白性,不稳定,以此来解答.
解答 解:A.漂白粉的有效成分是次氯酸钙(Ca(ClO)2),由于次氯酸的酸性比碳酸弱,次氯酸钙能与二氧化碳和水反应生成具有漂白性的次氯酸,故A正确;
B.漂白粉暴露在空气中与水、二氧化碳反应生成HClO,HClO不稳定易分解,则久置后能变质,故B正确;
C.工业用氯气和石灰乳反应制备漂白粉,发生2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2,主要成分为CaCl2、Ca(ClO)2,故C正确;
D.HClO的酸性比碳酸弱,无需加入浓盐酸,且加盐酸时Ca(ClO)2、CaCl2反应生成有毒的氯气,故D错误;
故选D.
点评 本题考查漂白粉的制备及性质,为高频考点,把握物质的组成、性质及用途是解本题关键,侧重分析、应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.现有原子序数依次增大的A、B、C、D、E、F六种短周期元素,它们可两两组成甲、乙、丙、丁、戊五种化合物,各化合物中原子个数比关系如下:
其中A、B两种元素的原子核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;B、C和D为同周期相邻元素,E和F位于同一周期,且二者原子序数之和为29.
(1)写出甲、丙、丁、戊四种物质的化学式:
甲H2O,丙Mg3N2,丁MgCl2,戊CCl4.
(2)乙的结构式为O=C=O,戊的一种用途是萃取剂、灭火剂或有机溶剂.
(3)化合物丙属于离子化合物(填“离子”或“共价”),丙具有类似盐类水解的性质,它与水反应可生成一种碱和一种常见气体,请写出丙与水反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
| 甲 | 乙 | 丙 | 丁 | 戊 |
| A:D=2:1 | B:D=1:2 | E:C=3:2 | E:F=1:2 | B:F=1:4 |
(1)写出甲、丙、丁、戊四种物质的化学式:
甲H2O,丙Mg3N2,丁MgCl2,戊CCl4.
(2)乙的结构式为O=C=O,戊的一种用途是萃取剂、灭火剂或有机溶剂.
(3)化合物丙属于离子化合物(填“离子”或“共价”),丙具有类似盐类水解的性质,它与水反应可生成一种碱和一种常见气体,请写出丙与水反应的化学方程式:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑.
6.如图所示的四种短周期元素W、X、Y、Z,它们的原子最外层电子数之和为22,下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素气态氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | W、X、Z三种元素最高价氧化物对应的水化物的酸性依次增强 | |
| D. | W、X、Z三种元素最高正化合价依次升高 |
5.今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按如图方式进行转化:
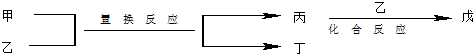
其推断正确的是( )

其推断正确的是( )
| 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
| NH3 | O2 | NO | H2O | NO2 | |
| Mg | CO2 | C | MgO | CO | |
| C | H2O | CO | H2 | CO2 | |
| FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
12.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲.
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g.
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
根据上述实验回答:
(1)一定不存在的离子是Fe3+、Mg2+、CO32-、Ba2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
(3)试确定K+是否存在是(填“是”或“否”),判断的理由是溶液中肯定存在的离子Al3+、NH4+、SO42-,经计算Al3+、NH4+物质的量都是0.02mol,SO42-物质的量是0.05mol,根据电荷守恒,K+一定存在.
①第一份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲.
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g.
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
根据上述实验回答:
(1)一定不存在的离子是Fe3+、Mg2+、CO32-、Ba2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mol•L-1) |
2.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)?2Z(g)△H<0.当改变某个条件并达到新平衡后,下列叙述正确的( )
| A. | 升高温度,X的体积分数减小 | |
| B. | 增大压强(缩小容器容积),Z的浓度不变 | |
| C. | 保持容器容积不变,充入一定量的惰性气体,Y的浓度不变 | |
| D. | 保持容器容积不变,充入一定量的Z,X的体积分数增大 |
9.已知常温下,在溶液中发生如下反应,由此推断下列说法正确的是( )
①16H++10Z-+2XO4-═2X2++5Z2+8H2O;
②2A2++B2═2A3-+2B-;
③2B-+Z2═B2+2Z-.
①16H++10Z-+2XO4-═2X2++5Z2+8H2O;
②2A2++B2═2A3-+2B-;
③2B-+Z2═B2+2Z-.
| A. | Z元素在反应①中被还原,在反应③中被氧化 | |
| B. | 反应Z2+2A2+═2A3++2Z-可以进行 | |
| C. | 氧化性由强到弱的顺序是XO4-,Z2,B2,A3+ | |
| D. | 还原性由强到弱的顺序是Z-,B-,A2+,X2+ |
6.以下实验操作简便、科学且成功的是( )
| A. | 将乙酸和乙醇的混合物注入浓硫酸中制备乙酸乙酯 | |
| B. | 将铜丝在酒精灯的外焰上加热变黑后,插入乙醇溶液中铜丝又恢复到原来的红色 | |
| C. | 往试管中注入2mLCuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀产生 | |
| D. | 向淀粉溶液中加入稀硫酸加热,一段时间后,再加入银氨溶液检验是否水解 |
7.下列说法中正确的是( )
| A. | 用明矾对自来水进行杀菌消毒 | |
| B. | 钠长期放置在空气中,最终将变成碳酸氢钠 | |
| C. | CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构 | |
| D. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I |