题目内容
【题目】在20℃时,在一容积不变的容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室。左室充入氮气,右室充入氢气与氧气的混合气体,活塞恰好停留在离左端的1/4处(如下图左所示),然后引燃氢、氧混合气体,反应完毕后恢复至原来温度,活塞恰好停在中间(如下图右所示),如果忽略水蒸气体积,则反应前氢气与氧气的体积比可能是
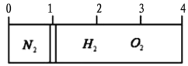

A. 3∶4 B. 4∶5 C. 6:2 D. 3∶7
【答案】B
【解析】
利用同温同压下,气体体积比等于气体物质的量之比,反应前氮气和氢气氧气混合物物质的量之比为1:3,反应后氮气和剩余气体物质的量之比为1:1。
同温同压下,气体体积比等于气体物质的量之比,反应前氮气和氢气氧气混合物物质的量之比为1:3,假设氮气物质的量为1mol,氢气和氧气的混合气体物质的量为3mol,反应后氮气和剩余气体物质的量之比为1:1,氮气物质的量为1mol,剩余气体物质的量为1mol,参与反应的气体物质的量为2mol。
利用2H2+O2![]() 2H2O,可知参与反应的氢气和氧气物质的量之比为2:1,参与反应的n(H2)=
2H2O,可知参与反应的氢气和氧气物质的量之比为2:1,参与反应的n(H2)=![]() mol,n(O2)=
mol,n(O2)=![]() mol。
mol。
若剩余气体为H2,氢气与氧气的体积之比![]() ;若剩余气体为O2,氢气与氧气的体积之比
;若剩余气体为O2,氢气与氧气的体积之比![]() 。
。
答案为:B。

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案
相关题目