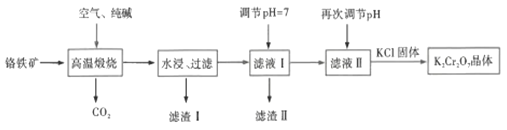
题目内容
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3mol电子时,消耗H2SO4的质量是___g,产生氢气的体积(标准状况)_____L。
(2)反应②中_______作氧化剂,________是氧化产物。
(3)当反应②中生成11.2LSO2气体(标准状况下)时,被还原的H2SO4的物质的量是____。
(4)用双线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)_______。
(5)反应③中氧化产物与还原产物的物质的量之比为________。
【答案】147 33.6 H2SO4(浓) CuSO4 0.5mol 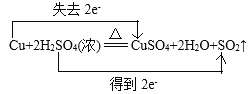 5:1
5:1
【解析】
(1)根据元素化合价升降总数等于反应中电子转移总数,结合n=![]() 、V=n·Vm计算;
、V=n·Vm计算;
(2)根据元素化合价升高,失去电子,该物质被氧化产生氧化产物,该物质作还原剂;元素化合价降低,获得电子,该物质被还原产生还原产物,该物质作氧化剂分析;
(3)由V=n·Vm计算SO2的物质的量,结合反应的H2SO4中元素化合价变化情况判断其作用;
(4)根据元素化合价升高,失去电子;元素化合价降低,获得电子,电子转移数目相等分析。
(5)根据还原剂失去电子,变为氧化产物;氧化剂获得电子,变为还原产物分析。
(1)①根据反应Fe+H2SO4(稀)=FeSO4+H2↑方程式可知:反应消耗1mol硫酸,转移2mol电子,产生1molH2,则当转移3mol电子时,消耗H2SO4的物质的量是1.5mol,其质量是m=1.5mol×98g/mol=147g,同时产生氢气1.5mol,其在标准状况下的体积V=1.5mol×22.4L/mol=33.6L。
②在反应Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑中,S元素的化合价由反应前H2SO4中的+6价变为反应后SO2中的+4价,化合价降低,获得电子,被还原,H2SO4(浓)作氧化剂;Cu元素的化合价由反应前Cu单质的0价变为反应后CuSO4中的+2价,化合价升高,失去电子,被氧化,所以Cu是还原剂,CuSO4是氧化产物;
CuSO4+2H2O+SO2↑中,S元素的化合价由反应前H2SO4中的+6价变为反应后SO2中的+4价,化合价降低,获得电子,被还原,H2SO4(浓)作氧化剂;Cu元素的化合价由反应前Cu单质的0价变为反应后CuSO4中的+2价,化合价升高,失去电子,被氧化,所以Cu是还原剂,CuSO4是氧化产物;
(3)当反应②中生成11.2LSO2气体(标准状况下)时,n(SO2)=![]() =0.5mol,在该反应中,每有2mol硫酸参加反应,被还原的H2SO4的物质的量是1mol,同时产生1molSO2,则反应产生0.5molSO2气体,被还原的H2SO4的物质的量是0.5mol。
=0.5mol,在该反应中,每有2mol硫酸参加反应,被还原的H2SO4的物质的量是1mol,同时产生1molSO2,则反应产生0.5molSO2气体,被还原的H2SO4的物质的量是0.5mol。
(4)在反应Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑中,Cu元素的化合价由反应前Cu单质的0价变为反应后CuSO4中的+2价,化合价升高2价,失去2e-;S元素的化合价由反应前H2SO4中的+6价变为反应后SO2中的+4价,化合价降低2价,获得2e-,用双线桥法表示反应②电子转移的方向和数目为:
CuSO4+2H2O+SO2↑中,Cu元素的化合价由反应前Cu单质的0价变为反应后CuSO4中的+2价,化合价升高2价,失去2e-;S元素的化合价由反应前H2SO4中的+6价变为反应后SO2中的+4价,化合价降低2价,获得2e-,用双线桥法表示反应②电子转移的方向和数目为: 。
。
(5)反应③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,Cl元素由反应前KClO3中的+5价变为反应后Cl2中的0价,化合价降低,获得电子5e-,KClO3是氧化剂,Cl2是还原产物;Cl元素由反应前KCl中的-1价变为反应后Cl2中的0价,化合价升高,失去电子5×e-,KCl是还原剂,Cl2是氧化产物;Cl2既是氧化产物又是还原产物,其中氧化产物与还原产物的物质的量之比为5:1。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D