题目内容
二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
Ⅰ、合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是 .
A、低温高压 B、加催化剂 C、体积不变充入N2 D、增加CO浓度 E、分离出二甲醚
Ⅱ、二甲醚燃料电池的工作原理如图一所示.

(1)该电池正极的电极反应式为 . 电池在放电过程中,b对应的电极周围溶液的pH .(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.
①X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式: .
②X、Y分别为铜、银,a为1L 0.2mol/L AgNO3溶液,写出Y电极反应式: .
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①结合图三计算,上述电解过程中消耗二甲醚的质量为 .
②若图三的B点pH=7,则滴定终点在 区间(填“AB”、“BC”或“CD”).
③C点溶液中各离子浓度大小关系是 .
Ⅰ、合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是
A、低温高压 B、加催化剂 C、体积不变充入N2 D、增加CO浓度 E、分离出二甲醚
Ⅱ、二甲醚燃料电池的工作原理如图一所示.

(1)该电池正极的电极反应式为
(2)以上述电池为电源,通过导线与图二电解池相连.
①X、Y为石墨,a为2L 0.1mol/L KCl溶液,写出电解总反应的离子方程式:
②X、Y分别为铜、银,a为1L 0.2mol/L AgNO3溶液,写出Y电极反应式:
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①结合图三计算,上述电解过程中消耗二甲醚的质量为
②若图三的B点pH=7,则滴定终点在
③C点溶液中各离子浓度大小关系是
考点:化学电源新型电池,化学平衡的影响因素,电解原理
专题:化学平衡专题,电化学专题
分析:I.要提高CO的转化率,改变条件使反应向正反应方向移动,可以通过改变温度、压强、浓度使平衡向正反应方向移动;
II.(1)根据氢离子移动方向知,左边电极是负极,通入燃料二甲醚,右边电极是正极,通入氧化剂氧气,该燃料电池中,正极上氧气得电子和氢离子反应生成水;
电池在放电过程中,b对应的电极上二甲醚失电子生成氢离子,导致氢离子浓度增大;
(2)①X、Y为石墨,放电时,阳极上氢氧根离子放电、阴极上氢离子放电;
②X、Y分别为铜、银,Y是阳极,阳极上银失电子发生氧化反应;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据KOH和转移电子正极的关系式计算转移电子,再根据转移电子守恒计算二甲醚的质量;
②滴定终点二者恰好反应生成CH3COOK;
③C点溶液中的溶质是CH3COOK和CH3COOH,溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度.
II.(1)根据氢离子移动方向知,左边电极是负极,通入燃料二甲醚,右边电极是正极,通入氧化剂氧气,该燃料电池中,正极上氧气得电子和氢离子反应生成水;
电池在放电过程中,b对应的电极上二甲醚失电子生成氢离子,导致氢离子浓度增大;
(2)①X、Y为石墨,放电时,阳极上氢氧根离子放电、阴极上氢离子放电;
②X、Y分别为铜、银,Y是阳极,阳极上银失电子发生氧化反应;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据KOH和转移电子正极的关系式计算转移电子,再根据转移电子守恒计算二甲醚的质量;
②滴定终点二者恰好反应生成CH3COOK;
③C点溶液中的溶质是CH3COOK和CH3COOH,溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度.
解答:
解:I.要提高CO的转化率,改变条件使反应向正反应方向移动,可以通过改变温度、压强、浓度使平衡向正反应方向移动,
A、低温高压平衡向正反应方向移动,所以能提高CO的转化率,故正确;
B、加催化剂只能改变反应速率,不能改变平衡移动方向,故错误;
C、体积不变充入N2,反应物和生成物浓度不变,则化学反应不移动,所以不能提高CO的转化率,故错误;
D.增加CO浓度平衡向正反应方向移动,但CO的转化率减小,故错误;
E、分离出二甲醚,二甲醚浓度减小,平衡向正反应方向移动,则能提高CO的转化率,故正确;
故选AE;
II.(1)根据氢离子移动方向知,左边电极是负极,通入燃料二甲醚,右边电极是正极,通入氧化剂氧气,该燃料电池中,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O;
电池在放电过程中,b对应的电极上二甲醚失电子生成氢离子,导致氢离子浓度增大,则溶液的pH减小;
故答案为:O2+4e-+4H+=2H2O;减小;
(2)①X、Y为石墨,放电时,阳极上氢氧根离子放电、阴极上氢离子放电,所以电池反应式为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
②X、Y分别为铜、银,Y是阳极,阳极上银失电子发生氧化反应,电极反应式为Ag-e-=Ag+,
故答案为:Ag-e-=Ag+;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据2Cl-+2H2O
2OH-+H2↑+Cl2↑知,生成0.2mol氢氧根离子转移电子的物质的量=
×2=0.2mol,二甲醚燃料电池的总反应方程式是CH3OCH3+3O2=2CO2+3H2O,二甲醚转化为CO2,消耗1mol二甲醚转移电子数=2×[4-(-2)]=12mol,因此当转移0.2mol电子时消耗二甲醚的质量=
×46g/mol=0.77g,
故答案为:0.77g;
②滴定终点二者恰好反应生成CH3COOK,KOH的浓度是醋酸的一半,则恰好中和时需要酸的体积等于KOH体积的一半,醋酸钾为强碱弱酸盐,其溶液呈碱性,当溶液的pH=7时,醋酸稍微过量,所以醋酸体积大于KOH体积的一半,所以滴定终点为AB段,故答案为:AB;
③C点溶液呈酸性则c(H+)>c(OH-),结合电荷守恒c(K+)+c(H+)=c(CH3COO-)+c(OH-),得到c(CH3COO-)>c(K+),所以溶液中离子浓度大小顺序是:c(CH3COO-)>c(K+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(K+)>c(H+)>c(OH-).
A、低温高压平衡向正反应方向移动,所以能提高CO的转化率,故正确;
B、加催化剂只能改变反应速率,不能改变平衡移动方向,故错误;
C、体积不变充入N2,反应物和生成物浓度不变,则化学反应不移动,所以不能提高CO的转化率,故错误;
D.增加CO浓度平衡向正反应方向移动,但CO的转化率减小,故错误;
E、分离出二甲醚,二甲醚浓度减小,平衡向正反应方向移动,则能提高CO的转化率,故正确;
故选AE;
II.(1)根据氢离子移动方向知,左边电极是负极,通入燃料二甲醚,右边电极是正极,通入氧化剂氧气,该燃料电池中,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O;
电池在放电过程中,b对应的电极上二甲醚失电子生成氢离子,导致氢离子浓度增大,则溶液的pH减小;
故答案为:O2+4e-+4H+=2H2O;减小;
(2)①X、Y为石墨,放电时,阳极上氢氧根离子放电、阴极上氢离子放电,所以电池反应式为:2Cl-+2H2O
| ||
| ||
②X、Y分别为铜、银,Y是阳极,阳极上银失电子发生氧化反应,电极反应式为Ag-e-=Ag+,
故答案为:Ag-e-=Ag+;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据2Cl-+2H2O
| ||
| 0.2mol |
| 2 |
| 0.2mol |
| 12 |
故答案为:0.77g;
②滴定终点二者恰好反应生成CH3COOK,KOH的浓度是醋酸的一半,则恰好中和时需要酸的体积等于KOH体积的一半,醋酸钾为强碱弱酸盐,其溶液呈碱性,当溶液的pH=7时,醋酸稍微过量,所以醋酸体积大于KOH体积的一半,所以滴定终点为AB段,故答案为:AB;
③C点溶液呈酸性则c(H+)>c(OH-),结合电荷守恒c(K+)+c(H+)=c(CH3COO-)+c(OH-),得到c(CH3COO-)>c(K+),所以溶液中离子浓度大小顺序是:c(CH3COO-)>c(K+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(K+)>c(H+)>c(OH-).
点评:本题考查了原电池和电解池原理、酸碱中和滴定等知识点,这些知识点都是考试热点,知道原电池和电解池中各个电极上发生的电极反应式,近几年中化学电源新型电池及燃料电池考查较多,离子浓度大小比较常常与盐类水解和弱电解质电离联合考查,为学习难点,要熟练掌握基本知识,灵活运用基础知识解答问题,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A、上述气体检测时,敏感电极均作电池正极 |
| B、检测Cl2气体时,敏感电极的电极反应为:Cl2+2e-═2Cl- |
| C、检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-═4OH- |
| D、检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同 |
 反应2X(g)+Y(g)?2Z△H<0 在不同温度和压强下,产物Z的物质的量与反应时间的关系如图所示.则下列叙述正确的是( )
反应2X(g)+Y(g)?2Z△H<0 在不同温度和压强下,产物Z的物质的量与反应时间的关系如图所示.则下列叙述正确的是( )| A、T1>T2,P1<P2 |
| B、T1>T2,P1>P2 |
| C、T1<T2,P1>P2 |
| D、T1<T2,P1<P2 |
下列化学反应方程式或离子方程式书写正确的是( )
| A、乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |||
B、乙醇催化氧化:2CH3CH2OH+O2
| |||
C、苯与氢气加成: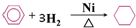 | |||
| D、从海带中提取碘:H2O2+2I-+2H+=I2+2H2O |
据报道,美国科学家制得一种新原子
X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是( )
283 116 |
| A、这种元素一定是金属元素 |
| B、它位于元素周期表中的第六周期 |
| C、这种原子的核外电子数为167 |
| D、这种元素的原子易与氢化合 |


 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题: