题目内容
【题目】在Fe2(SO4)3溶液中,加入a g铜,完全溶解后,再加入b g铁,充分反应后得到cg残余固体,已知a>c,则下列说法正确的是( )
A.最后得到的溶液一定含有Cu2+
B.残余固体是铜和铁
C.将残余固体加入稀硫酸中一定有气泡产生
D.最后得到的溶液中可能含有Fe3+
【答案】A
【解析】
发生的反应有:2Fe3++Cu=2Fe2++Cu2+,Cu2++Fe=Cu+Fe2+,a>c,说明铜没有被完全置换出,以此计算分析.
a>c,说明铜没有被完全置换出;则溶液中一定存在Cu2+,
铜有剩余,发生的反应有:2Fe3++Cu=2Fe2++Cu2+,则一定不存在Fe3+,
故选:A。

【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
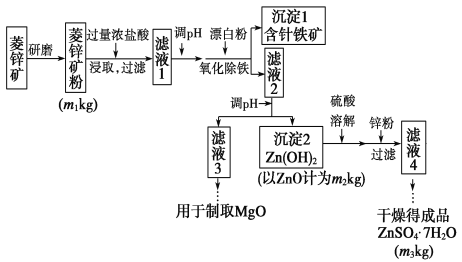
(1)完成“氧化除铁”步骤中反应的离子方程式:
(_________)Fe(OH)2+(________)________+(_________)______===(________)Fe(OH)3+(_________)Cl-
(2)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp mol3·L-3 | 5.6×10-12 | — | 6.8×10-10 | 2.8×10-9 |
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰粉 c.纯碱溶液 d.烧碱溶液
(5)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________________。