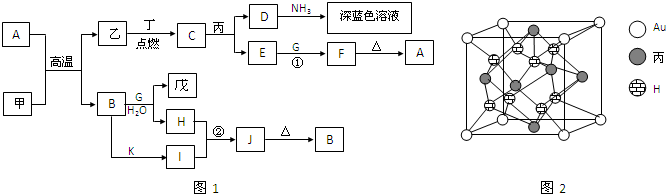
题目内容
化合物甲由不同周期的短周期元素X、Y组成,是良好的耐热冲击材料.
X原子的最外层电子数比次外层电子数少5,Y元素是空气中含量最高的元素.
(1)X的原子结构示意图是 ,甲的化学式是 .
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 .
(3)1mol X单质与Fe2O3反应,放出414.21KJ热量,该反应的热化学反应方程式是 .
(4)利用以X为阳极,在H2SO4 溶液中电解的方法,可在X表面形成X的氧化物,此方法可用于工业制备氧化膜,写出阳极电极反应式 .
(5)一定条件下,甲和水缓慢作用生成含Y的化合物乙,乙分子含有10个电子.乙在微生物作用下可与O2发生反应,当有1mol 乙参加反应时,电子转移6mol,该反应的化学方程式是 .
X原子的最外层电子数比次外层电子数少5,Y元素是空气中含量最高的元素.
(1)X的原子结构示意图是
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为
(3)1mol X单质与Fe2O3反应,放出414.21KJ热量,该反应的热化学反应方程式是
(4)利用以X为阳极,在H2SO4 溶液中电解的方法,可在X表面形成X的氧化物,此方法可用于工业制备氧化膜,写出阳极电极反应式
(5)一定条件下,甲和水缓慢作用生成含Y的化合物乙,乙分子含有10个电子.乙在微生物作用下可与O2发生反应,当有1mol 乙参加反应时,电子转移6mol,该反应的化学方程式是
分析:化合物甲由不同周期的短周期元素X、Y组成,是良好的耐热冲击材料,X原子的最外层电子数比次外层电子数少5,则X是Al元素,Y元素是空气中含量最高的元素,则Y是N元素,所以甲是氮化铝,然后依据物质的性质来解答.
解答:解:化合物甲由不同周期的短周期元素X、Y组成,是良好的耐热冲击材料,X原子的最外层电子数比次外层电子数少5,则X是Al元素,Y元素是空气中含量最高的元素,则Y是N元素,所以甲是氮化铝,
(1)Al是13号元素,其原子核外有13个电子,铝原子核外有3个电子层,最外层有3个电子,其原子结构示意图为: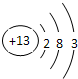 ,甲是氮化铝,其化学式为:AlN,
,甲是氮化铝,其化学式为:AlN,
故答案为: ,AlN;
,AlN;
(2)硫酸铝和过量氢氧化钠反应生成偏铝酸钠、硫酸钠和水,离子反应方程式为:Al3++4OH-═AlO2-+2H2O,
故答案为:Al3++4OH-═AlO2-+2H2O;
(3)1mol铝与氧化铁发生铝热反应放出414.21KJ热量,则2mol铝和氧化铁发生铝热反应放出828.42kJ热量,所以其热化学反应方程式为:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJ/mol,
故答案为:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJ/mol;
(4)电解稀硫酸时,阳极上铝失电子和水反应生成氧化铝,所以其电极反应式为:2Al+3H2O-6e-=Al2O3+6H+
,故答案为:2Al+3H2O-6e-=Al2O3+6H+;
(5)一定条件下,氮化铝和水缓慢作用生成含氮的化合物乙,乙分子含有10个电子,则乙是氨气,乙在微生物作用下可与O2发生反应,当有1mol乙参加反应时,电子转移6mol,则其生成物中氮元素的化合价是+3价,根据元素守恒知,含有氮元素的生成物是亚硝酸,同时还有水生成,所以其反应方程式为:2NH3+3O2
2HNO2+2H2O,故答案为:2NH3+3O2
2HNO2+2H2O.
(1)Al是13号元素,其原子核外有13个电子,铝原子核外有3个电子层,最外层有3个电子,其原子结构示意图为:
 ,甲是氮化铝,其化学式为:AlN,
,甲是氮化铝,其化学式为:AlN,故答案为:
 ,AlN;
,AlN;(2)硫酸铝和过量氢氧化钠反应生成偏铝酸钠、硫酸钠和水,离子反应方程式为:Al3++4OH-═AlO2-+2H2O,
故答案为:Al3++4OH-═AlO2-+2H2O;
(3)1mol铝与氧化铁发生铝热反应放出414.21KJ热量,则2mol铝和氧化铁发生铝热反应放出828.42kJ热量,所以其热化学反应方程式为:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJ/mol,
故答案为:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJ/mol;
(4)电解稀硫酸时,阳极上铝失电子和水反应生成氧化铝,所以其电极反应式为:2Al+3H2O-6e-=Al2O3+6H+
,故答案为:2Al+3H2O-6e-=Al2O3+6H+;
(5)一定条件下,氮化铝和水缓慢作用生成含氮的化合物乙,乙分子含有10个电子,则乙是氨气,乙在微生物作用下可与O2发生反应,当有1mol乙参加反应时,电子转移6mol,则其生成物中氮元素的化合价是+3价,根据元素守恒知,含有氮元素的生成物是亚硝酸,同时还有水生成,所以其反应方程式为:2NH3+3O2
| ||
| ||
点评:本题考查位置、结构、性质关系的应用,熟悉Al的性质、氧化还原反应、10电子微粒是解答本题的关键,难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目