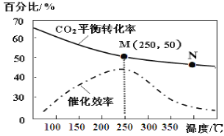
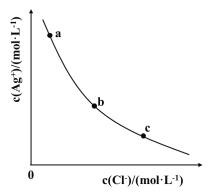
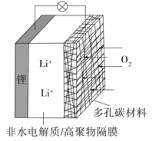
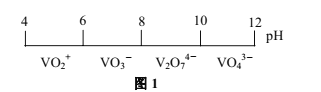
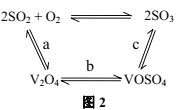
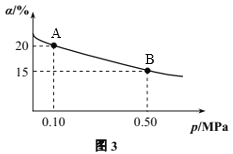
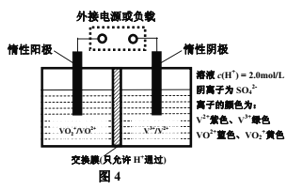
题目内容
【题目】某药物丙可由有机物甲和乙在一定条件下反应制得:
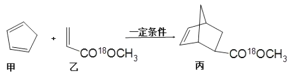
下列说法正确的是
A.丙在碱性条件下水解生成 和CH318OH
和CH318OH
B.甲分子中所有原子共平面
C.乙的化学式是C4H518OO
D.甲与乙生成丙的反应属于加成反应
【答案】D
【解析】
观察反应可知,如图,
![]()
![]()
甲的1、4位C分别和乙的1、2位C相连,形成六元环,同时甲的1、2,3、4,乙的1、2C之间的双键变成单键,并在甲的2、3位C之间形成双键,总的减少2个双键,得到单一产物,所以该反应应属加成反应。
A. 丙在碱性条件下水解生成羧酸盐,故A错误;
B. 甲分子中含有亚甲基,饱和碳及其相连的4个原子,只有3个原子共面,并不是所有原子共平面,故B错误;
C. 乙的化学式是C4H618OO,故C错误;
D.  碳碳双键断裂,变成碳碳单键,属于加成反应,故D正确;
碳碳双键断裂,变成碳碳单键,属于加成反应,故D正确;
答案选D。

【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15 mL苯和少量铁屑。在b中小心加入4.0 mL 液溴。再将b中液溴慢慢加入到a中,充分反应。装置a中发生的主要反应是___;装置d的作用是___。
(2)反应过程中,a外壁温度升高,为提高原料利用率,采取以下措施:
①采用装置c的目的是___。
②利用温度计控制温度,适宜的温度范围为(填序号)___。
A.>156℃ B. 59℃-80℃ C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。操作②所需要的玻璃仪器除烧杯外,还需___,滤液用NaOH溶液洗涤的作用是___。
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(4)经过上述分离操作后,粗溴苯中溶解的主要杂质为苯,要进一步提纯,下列操作中必须的是___(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取