题目内容
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,v正、v逆不变
④增大B的浓度,v正>v逆
⑤加入催化剂,B的转化率提高
A.①②B.②④C.①③D.②
【答案】B
【解析】
①A为纯固体,增加A的量,平衡不移动,①错误;
②升高温度,正、逆反应速率均增大,由于该反应的正反应为放热反应,所以升高温度,化学平衡逆向移动,②错误;
③该反应为气体体积不变的反应,增大压强,正、逆反应速率同等程度增大,因此平衡不移动,③错误;
④增大反应物浓度,平衡正向移动,则增大B的浓度,v正>v逆,④正确;
⑤催化剂能同等倍数的改变正、逆反应速率,因此对平衡移动无影响,则加入催化剂,B的转化率不变,⑤错误;可见说法正确的是②④;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】从接触法制硫酸的废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | VOSO4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
一种废钒催化剂回收工艺路线流程如下:
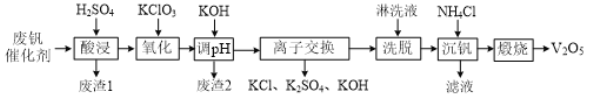
回答下列问题:
(1)“酸浸”时为了提高钒元素的浸出率,可以采取的措施是______。
(2)“酸浸”时可以得到![]() 和VO2+,“氧化”时VO2+转化为
和VO2+,“氧化”时VO2+转化为![]() 的离子方程式为______。
的离子方程式为______。
(3)“调pH”后钒以![]() 形式存在于溶液中。“废渣2”所含成分的化学式为____。
形式存在于溶液中。“废渣2”所含成分的化学式为____。
(4)“离子交换”和“洗脱”的过程可表示为:4ROH+![]()
![]() R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
(5)“沉钒”时得到偏钒酸铵(NH4VO3)沉淀。
①检验偏钒酸铵沉淀是否洗涤干净的方法是______。
②“煅烧”中发生反应的化学方程式为______。