题目内容
元素周期表是学习化学的重要工具,它包含许多信息和规律.如表所列是五种短周期元素的原子半径及主要化合价:
(1)用元素代号标出他们的周期表中对应位置
(2)在上面的元素周期表中通常寻找催化剂材料的区域,用斜线标出.
(3)五种元素中非金属性最强的是________(填元素符号),T、X形成化合物为________(填化学式).
(4)证明L元素与M元素在性质上有明显不同的离子方程式为________.
答案:
解析:
解析:
|
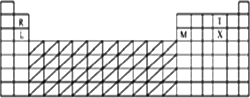
答案:(1)见(2)答案 (2)
(3)O SO2、SO3 (4)2Al+2OH-+2H2O 解析:化合价相似的元素处于同一主族,同一主族的元素的原子半径从上到下逐渐增大,同一周期的元素的原子半径从左到右逐渐减小,据此可以判断出它们分别属于什么元素,即可获得答案. (1)L和R都属于ⅡA族元素,Mg的原子半径比Be的大,所以L为Mg,R为Be;X和T都属于ⅥA族元素,S的原子半径比O的大,所以X为S,T为O;M属于ⅢA族元素,可能为B或Al,又因为Al的原子半径比X(S)的大,而B的原子半径比X(S)的小,所以M应该为Al. (2)通常在元素周期表中过渡元素中寻找催化剂材料. (3)元素周期表右上角的元素非金属性最强,所以这五种元素中,O元素的非金属性最强.它与硫元素可以形成SO2、SO3两种化合物. (4)Mg和Al都是活泼的金属元素,都能够和非氧化性酸反应生成氢气,但是Al还能够和强碱溶液反应生成氢气. |

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
元素周期律和元素周期表是学习化学的重要工具,下列叙述不正确的是( )
| A、从左到右,元素周期表中的第十五列为VA族 | B、某IIA族元素的原子序数为x,则与它同周期的IIIA族元素的原子序数可能为x+25 | C、VIA族元素,随原子半径增大,对应气态氢化物的稳定性增强 | D、53号元素位于周期表中第5周期VIIA族 |
 NH4++OH-
NH4++OH-