题目内容
下列有关说法正确的是
- A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度
- B.增大醋酸溶液的浓度,溶液中c(OH-)减小的原因是水的离子积Kw减小
- C.pH=3的盐酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱
- D.TATP(C8H18O6)受撞击分解爆炸,且无明显热效应,说明该分解反应熵显著增加
D
试题分析:A中锌能置换出铜,从而构成铜锌原电池,加快反应速率,A不正确;水的离子积常数只与温度有关系,B不正确,溶液中c(OH-)减小是由于溶液中氢离子浓度增大引起的;C中混合溶液呈碱性,说明LiOH是过量的,因此LiOH是弱碱,C不正确。D中反应是自发的,所以根据△G=△H-T·△S且反应中无明显热效应可知,该分解反应熵显著增加,D正确,答案选D。
考点:考查外界条件对反应速率的影响、水的离子积常数、弱电解质的电离平衡以及反应自发性的应用和判断
点评:该题是中等难度的试题,也是高考中的常见题型。试题贴近高考,难易适中,在注重对学生基础知识巩固和检验的同时,侧重对学生能力的培养,有利于培养学生的逻辑推理能力和创新思维能力,提高学生的应试能力和学习效率。
试题分析:A中锌能置换出铜,从而构成铜锌原电池,加快反应速率,A不正确;水的离子积常数只与温度有关系,B不正确,溶液中c(OH-)减小是由于溶液中氢离子浓度增大引起的;C中混合溶液呈碱性,说明LiOH是过量的,因此LiOH是弱碱,C不正确。D中反应是自发的,所以根据△G=△H-T·△S且反应中无明显热效应可知,该分解反应熵显著增加,D正确,答案选D。
考点:考查外界条件对反应速率的影响、水的离子积常数、弱电解质的电离平衡以及反应自发性的应用和判断
点评:该题是中等难度的试题,也是高考中的常见题型。试题贴近高考,难易适中,在注重对学生基础知识巩固和检验的同时,侧重对学生能力的培养,有利于培养学生的逻辑推理能力和创新思维能力,提高学生的应试能力和学习效率。

练习册系列答案
相关题目
 (2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )
(2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )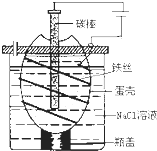 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置, (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.