题目内容
13.下列反应属于吸热反应的是( )| A. | 锌粒与稀硫酸的反应 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 甲烷在氧气中的燃烧 | |
| D. | 白磷自燃 |
分析 根据常见的放热反应有:所有的物质燃烧、金属与酸或水反应、中和反应、铝热反应、绝大多数化合反应等;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),八水合氢氧化钡与氯化铵的反应.
解答 解:A、金属和酸的反应为放热反应,故A错误;
B、碱和铵盐的反应为吸热反应,故Ba(OH)2•8H2O晶体与NH4Cl晶体的反应吸热,故B正确;
C、所有的燃烧均为放热反应,故甲烷在氧气中燃烧放热,故C错误;
D、所有的燃烧均为放热反应,故白磷的自燃放热,故D错误.
故选B.
点评 本题考查吸热反应和放热反应,难度不大,明确常见的吸热反应和放热反应是解题的关键.

练习册系列答案
相关题目
3.常温下,下列溶液中酸性最强的是( )
| A. | PH=4 | B. | C(H+)=1×10-3 mol•L-1 | ||
| C. | C(OH-)=1×10-12 | D. | C(H+)/C(OH-)=1012 |
4.白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:E(P-P)=a kJ•mol-1、E(P-O)=b kJ•mol-1、E(P=O)=c kJ•mol-1、E(O=O)=d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )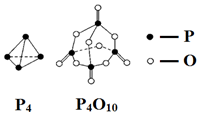

| A. | -(6a-12b-4c+5d)kJ•mol-1 | B. | -(-6a+12b+4c-5d)kJ•mol-1 | ||
| C. | -(-4a+6b+4c-5d)kJ•mol-1 | D. | -(4a-6b-4c+5d)kJ•mol-1 |
1. 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A. | 碱 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 碱 | 酚酞 | 甲 |
| C. | 碱 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
8.某无色溶液X中,可能含有Na+、Cu2+、Mg2+、Al3+、SiO32-、AlO2-、CO32-、Cl-中的一种或几种.现取该溶液适量,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列说法中不正确的是( )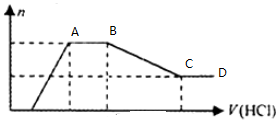

| A. | 溶液X中一定不含Cu2+、Mg2+、Al3+,可能含有Cl- | |
| B. | OA段参加反应的阴离子的物质的量之比为2:1或1:2 | |
| C. | AB段一定生成了气体 | |
| D. | BC段发生反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O |
18.在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)?Y(g);(乙)A(s)+2B(g)?C(g)+D(g),当下列物理量不再发生变化时( )
①混合气体的密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于系数之比 ④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量.其中能表明(甲) (乙)达到化学平衡状态有.
①混合气体的密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于系数之比 ④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量.其中能表明(甲) (乙)达到化学平衡状态有.
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ②③⑤ | D. | ②③④ |
5.下列物质暴露在空气中容易变质的是( )
| A. | 葡萄糖 | B. | 食盐水 | C. | 硫酸钠溶液 | D. | 氢氧化钠 |
11.在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如表:
下列说法正确的是( )
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | |||
| ① | 700 | 0.40 | 0.10 | 0.090 | |
| ② | 800 | 0.10 | 0.40 | 0.080 | |
| ③ | 800 | 0.20 | 0.30 | a | |
| ④ | 900 | 0.10 | 0.15 | b | |
| A. | 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol•L-1•min-1 | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.060 |
 根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,
根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,