题目内容
【题目】如表为长式周期表的一部分,其中的编号代表对应的元素. 
请回答下列问题:
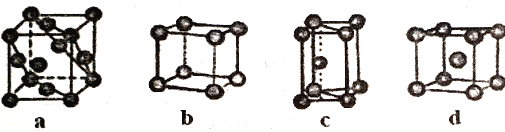
(1)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为(用对应的元素符号表示).
(2)某元素的价电子排布式为nsnnpn+1 , 该元素与元素①形成的18电子的X分子的结构式为;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为 .
(3)比较③,⑤,⑥,⑦,⑧五种元素的电负性大小,由大到小排列的顺序为(用 元素符号表示).
(4)⑩元素单质晶体采取堆积方式 , 空间利用率为 . 
【答案】
(1)MgNi3C
(2)![]() ;先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液
;先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液
(3)Ca<Al<S<Cl<O
(4)面心立方最密堆积;74%
【解析】解:由元素周期表可以得出元素①为H,②为C,③为O,④为Mg,⑤为Mn,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu;
(1.)②、④、⑨分别位于晶胞的体心、顶点、面心,C原子个数为1,Mg原子个数为8× ![]() =1,Ni原子个数为6×
=1,Ni原子个数为6× ![]() =3,化学式为MgNi3C,所以答案是:MgNi3C;
=3,化学式为MgNi3C,所以答案是:MgNi3C;
(2.)元素的特征电子排布式为nsnnpn+1 , 则n=2,故该元素的特征电子排布式为2s22p3 , 为N原子,元素与元素①形成的18电子的X分子为N2H4 , 其结构式为 ![]() ;元素①为H元素,与X形成的物质为NH3 , 与硫酸铜溶液先生成蓝色沉淀,后形成络合物,则观察到的现象为先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液,所以答案是:
;元素①为H元素,与X形成的物质为NH3 , 与硫酸铜溶液先生成蓝色沉淀,后形成络合物,则观察到的现象为先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液,所以答案是: ![]() ;先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液;
;先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液;
(3.)非金属性越强,电负性越大,则电负性从小到大顺序是Ca<Al<S<Cl<O,所以答案是:Ca<Al<S<Cl<O;
(4.)Cu单质的晶体堆积方式为面心立方密堆积,晶胞中Cu原子数目为8× ![]() +6×
+6× ![]() =4,设Cu原子半径为r,则晶胞中Cu原子总体积为4×
=4,设Cu原子半径为r,则晶胞中Cu原子总体积为4× ![]() πr3 , 设Cu原子半径为r,则晶胞棱长为4r×
πr3 , 设Cu原子半径为r,则晶胞棱长为4r× ![]() =2
=2 ![]() r,晶胞体积为(2
r,晶胞体积为(2 ![]() r)3=16
r)3=16 ![]() r3 , 空间利用率=
r3 , 空间利用率= ![]() ×100%=74%,所以答案是:面心立方最密堆积;74%.
×100%=74%,所以答案是:面心立方最密堆积;74%.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案