题目内容
NA表示阿伏加德罗常数,有关NA的正确说法是
| A.1mol D318O+中含有的中子数为10NA |
| B.标准状况下,22.4L水中含O-H键数为2NA |
| C.某温度时1L pH=6的纯水所含OH-离子数为1.0×10-6NA |
| D.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA |
C
解析试题分析:A、1mol D318O+中含有的中子数为13NA,A不正确;B、标准状况下水不是气体,不能适用于气体摩尔体积,B不正确;C、任何温度下纯水中氢离子浓度等于OH-浓度,所以某温度时1L pH=6的纯水所含OH-离子数为1.0×10-6NA,C正确;D、过氧化钠和硫化钠的相对分子质量都是78,且阴阳离子的个数之比都是1:2,因此7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1 NA,D不正确,答案选C。
考点:考查阿伏加德罗常数的有关计算

练习册系列答案
相关题目
取不同质量的镁铝合金分别与25 mL同浓度的稀硝酸反应,测量合金的质量与产生气体的体积(标准状况),列表如下:
| 实验编号 | 合金质量(mg) | 气体体积(mL) |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
若第3个实验后向反应容器内加入足量的1.0 mol/L NaOH(aq)充分反应,使固体质量不再发生变化。硝酸的浓度及至少需要NaOH(aq)的体积是
| 硝酸的浓度 | NaOH(aq)的体积 | ||
| A. | B. | C. | D. |
| 4.0 mol/L | 1.0 mol/L | 75 mL | 99 mL |
取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1 mol H2SO4),恰好完全反应成盐和水,原混合物中氧元素的质量是
| A.6.4g | B.3.2g | C.1.6g | D.0.8g |
微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是
| A.C3H6、CH2=CHCH3 | B.-OH、 |
C. 、 、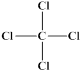 | D. 、1s22s22p63s23p6 、1s22s22p63s23p6 |
下列有关化学用语表示正确的是
A.四氯化碳分子比例模型: |
| B.次氯酸的结构式为 H-Cl-O |
C.COS的电子式是 |
D.O2-离子结构示意图: |
下列有关化学用语表示正确的是
A.中子数为18的硫原子: |
B.COCl2的电子式: |
C.Al3+的结构示意图: |
D.聚丙烯的结构简式: |
下列说法中正确的是
| A.一定条件下下向1L容器内通入46gNO2,则NO2 的物质的量浓度一定为1mol/L |
| B.标况下22.4L的己烷中有20NA原子 |
| C.1mol氯气溶于水转移1mol e- |
| D.1molNa2O2与足量水反应,转移1mol e-,生成0.5molO2 |
设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
| A.1L0.1mol·L-1的氨水中含有的NH3分子数为0.1NA |
| B.标准状况下,2. 24L的CCl4中含有的C-Cl键数为0.4NA |
| C.常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
| D.标准状况下,Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.4NA |
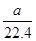 ×6.02×1023
×6.02×1023