��Ŀ����
����Ŀ������β������Ҫ�ɷ�ΪNOx��CO���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ����Դ֮һ���з����⻯ѧ������Ⱦ��DZ��Σ�ա�
��1��ijС��ͬѧΪ�о��⻯ѧ�������γɽ�����ģ��ʵ�顣�����������Ҫ�ɷ�ΪCxHy(��)��NO��NO2��O3��PAN ��CH3COOONO2�����������ʵ����Ũ����ʱ��ı仯����ͼ������ͼ�����ݣ������������������_____������ѡ�������ĸ��

a��NO����ʧ�����ʱ�CxHy�� b��NO����NO2
c��CxHy��NO2��������PAN��O3 d��O3����PAN
��2��һ�������£���2 mol NO��2 mol O2���ں����ܱ������з�����Ӧ2NO(g)��O2(g) ![]() 2NO2(g)�����п��жϷ�Ӧ��ƽ�����_____������ѡ�������ĸ��
2NO2(g)�����п��жϷ�Ӧ��ƽ�����_____������ѡ�������ĸ��
a����ϵѹǿ���ֲ��� b����������ܶȱ��ֲ���
c��NO��O2�����ʵ���֮�ȱ��ֲ��� d��ÿ����2 mol NOͬʱ����2 mol NO2
��3��������N2��O2����N2(g)��O2(g)![]() 2NO(g)��Ӧ���ǵ�������β���к���NO��ԭ��֮һ��
2NO(g)��Ӧ���ǵ�������β���к���NO��ԭ��֮һ��
����ͼ��T1��T2���ֲ�ͬ�¶��£�һ������NO�����ֽ������N2�����������ʱ��仯��ͼ�ݴ��жϷ�ӦN2(g)��O2(g)![]() 2NO(g)Ϊ_____��������������������������Ӧ��
2NO(g)Ϊ_____��������������������������Ӧ��

��2000��ʱ�����ݻ�Ϊ2 L���ܱ������г���10 mol N2��5 mol O2���ﵽƽ���NO�����ʵ���Ϊ2 mol����˿̷�Ӧ��ƽ�ⳣ��K��_____�����¶��£�����ʼʱ�����������г���N2��O2��Ϊ1 mol����ﵽƽ���N2��ת����Ϊ_____��

����������װ����װ�к�Pd������Ĵ����������ڴ�������������������õĻ�������ͼ��ʾ��д����仯���ܻ�ѧ��Ӧ����ʽ��_____��
��4��Ϊ��������β����NOx���ŷţ�������CxHy����������ԭNOx���������������Ⱦ��
���磺CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g) ��H1����574 kJ/mol
CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g) ��H2
��16 g CH4��ԭNO2��N2�����ų�����867 kJ������H2��_____�����ñ�״����4.48 L CH4��ԭNO2��N2����ת�Ƶĵ�������Ϊ_____�������ӵ�������ֵ��NA��ʾ����
���𰸡� d ac ���� 1/9��0.11 1/7��14.3% 2NO��O2��4CO![]() 4CO2��N2 ��1160 kJ��mol-1 1.6 NA
4CO2��N2 ��1160 kJ��mol-1 1.6 NA
�����������������������Ҫ����ͼ��ķ�������ѧƽ��ı�־����ѧƽ��ļ��㣬��Ӧ�ȵļ�����������ԭ��Ӧ��ת�Ƶ������ļ�����
��1��a������ͼʾ����һ��ʱ���ڣ�NO��ʧ�����ʱ�CxHy����a�������b����ͼʾ����ʼNO���ٵ�ͬʱNO2������NO����NO2��b�������c����ͼʾ��CxHy��NO2���ٵ�ͬʱPAN��O3���࣬���ԭ���غ㣬CxHy��NO2������PAN��O3��c�������d��O3Ũ��ʼ��������O3��������PAN��d���������ѡd��
��2��a���÷�Ӧ������ӦΪ�����������С�ķ�Ӧ������ƽ�����������������ʵ�����С���ں��º��������У���ϵѹǿ��С��ƽ��ʱ����������ʵ������䣬��ϵѹǿ���䣬��ϵѹǿ�������жϷ�Ӧ�ﵽƽ�⣻b���÷�Ӧ���������ʶ������壬���������غ㶨�ɣ�������������ʼ�ղ��䣬������������䣬���������ܶ�ʼ�ղ��䣬��������ܶȱ��ֲ��䲻��˵����Ӧ�ﵽƽ�⣻c����ʼNO��O2���ʵ�����ȣ�����ƽ�������ת����NO��O2���ʵ���֮��Ϊ2:1������ƽ�������NO��O2���ʵ���֮�ȼ�С��ƽ��ʱNO��O2���ʵ���֮�Ȳ��ٱ仯��NO��O2���ʵ���֮�ȱ��ֲ���˵����Ӧ�ﵽƽ�⣻d��ÿ����2molNOͬʱ����2molNO2ֻ��ʾ����Ӧ������˵����Ӧ�ﵽƽ�⣻��˵����Ӧ�ﵽƽ�����ac����ѡac��
��3������ͼ��ɼ�T2�ȳ��ֹյ㣬˵��T2��Ӧ���ʿ죬��T2![]() T1��T2ƽ��ʱN2���������С��T1ʱ��˵�������¶ȣ���Ӧ2NO��g��
T1��T2ƽ��ʱN2���������С��T1ʱ��˵�������¶ȣ���Ӧ2NO��g��![]() N2��g��+O2��g�������ƶ�����Ӧ2NO��g��
N2��g��+O2��g�������ƶ�����Ӧ2NO��g��![]() N2��g��+O2��g�����淴ӦΪ���ȷ�Ӧ����N2��g��+O2��g��
N2��g��+O2��g�����淴ӦΪ���ȷ�Ӧ����N2��g��+O2��g��![]() 2NO��g��Ϊ���ȷ�Ӧ��
2NO��g��Ϊ���ȷ�Ӧ��
��������ʽ
N2��g��+O2��g��![]() 2NO��g��
2NO��g��
n����ʼ����mol�� 10 5 0
n��ת������mol�� 1 1 2
n��ƽ�⣩��mol�� 9 4 2
ƽ��ʱN2��O2��NO���ʵ���Ũ������Ϊ4.5mol/L��2mol/L��1mol/L����Ӧ��ƽ�ⳣ��K=![]() =
=![]() =
=![]() =0.11������ʼ�������г���N2��O2��Ϊ1mol����ӿ�ʼ��ƽ��ʱת��N2���ʵ���Ϊx��������ʽ
=0.11������ʼ�������г���N2��O2��Ϊ1mol����ӿ�ʼ��ƽ��ʱת��N2���ʵ���Ϊx��������ʽ
N2��g��+O2��g��![]() 2NO��g��
2NO��g��
n����ʼ����mol�� 1 1 0
n��ת������mol�� x x 2x
n��ƽ�⣩��mol�� 1-x 1-x 2x
ƽ��ʱN2��O2��NO���ʵ���Ũ������Ϊ��1-x��/2mol/L����1-x��/2mol/L��xmol/L��K=![]() =
=![]() =
=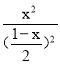 �����x=
�����x=![]() mol���ﵽƽ���N2��ת����Ϊ
mol���ﵽƽ���N2��ת����Ϊ![]() =
=![]() =0.143��
=0.143��
������ͼʾ�������ķ�ӦΪ2NO+O2=2NO2����ʽ����NO2��CO�ڴ�������������CO2��N2����ӦΪ2NO2+4CO![]() N2+4CO2����ʽ��������ʽ+��ʽ�����ܻ�ѧ��Ӧ����ʽΪ��4CO+2NO+O2
N2+4CO2����ʽ��������ʽ+��ʽ�����ܻ�ѧ��Ӧ����ʽΪ��4CO+2NO+O2![]() N2+4CO2��
N2+4CO2��
��4��16gCH4��ԭNO2��N2���ų�����867kJ����1mol CH4��ԭNO2��N2���ų�����867kJ���ݴ˿�д���Ȼ�ѧ����ʽ��CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol����ʽ����CH4��g����4NO2��g��=4NO��g����CO2��g����2H2O��g�� ��H1=-574 kJ/mol����ʽ��������ʽ![]() 2-��ʽ��CH4��g����4NO��g��=2N2��g����CO2��g����2H2O��g�� ��H2=2��H-��H1=2
2-��ʽ��CH4��g����4NO��g��=2N2��g����CO2��g����2H2O��g�� ��H2=2��H-��H1=2![]() ��-867kJ/mol��-��-574kJ/mol��=-1160kJ/mol��n��CH4��=
��-867kJ/mol��-��-574kJ/mol��=-1160kJ/mol��n��CH4��=![]() =0.2mol���ڷ�Ӧ��CH4��������CO2����Ӧ��ת�Ƶ������ʵ���Ϊ0.2mol
=0.2mol���ڷ�Ӧ��CH4��������CO2����Ӧ��ת�Ƶ������ʵ���Ϊ0.2mol![]() 8=1.6mol��ת�Ƶ�������Ϊ1.6NA��
8=1.6mol��ת�Ƶ�������Ϊ1.6NA��

 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д�