题目内容
3. 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)(△H<0)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)(△H<0)(1)该反应的氧化剂是N2,其还原产物是Si3N4.
(2)该反应的平衡常数表达式为K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;若已知CO生成速率为v(CO)=18mol•L-1•min-1,则N2消耗速率为v(N2)=6mol•L-1•min-1.
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是升高温度或增大压强;图中表示平衡混合物中CO的含量最高的一段时间是t3~t4.
(4)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是50% (提示:272=729).
分析 (1)3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)中,C元素的化合价升高,N元素的化合价降低;
(2)K=生成物浓度幂之积与反应物浓度幂之积的比;CO生成速率为v(CO)=18mol•L-1•min-1,结合反应速率之比等于化学计量数之比计算v(N2);
(3)t4时正逆反应速率均增大,且逆反应速率大于正反应速率,则为升高温度或增大压强;从开始改变条件平衡均向正反应进行,t4时平衡逆向移动;
(4)在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,设转化的氮气为xmol,则
3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
开始 2mol 0
转化 x 3x
平衡 2-x 3x
$\frac{(3x)^{6}}{(2-x)^{2}}$=729,以此来解答.
解答 解:(1)3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)中,N元素的化合价降低,则N2为氧化剂,得到电子被还原,对应还原产物为Si3N4,
故答案为:N2;Si3N4;
(2)K=生成物浓度幂之积与反应物浓度幂之积的比,则平衡常数表达式为K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;CO生成速率为v(CO)=18mol•L-1•min-1,由反应速率之比等于化学计量数之比可知v(N2)=18mol•L-1•min-1×$\frac{2}{6}$=6 mol•L-1•min-1,
故答案为:K=$\frac{{c}^{6}(CO)}{{c}^{2}({N}_{2})}$;6 mol•L-1•min-1;
(3)t4时正逆反应速率均增大,且逆反应速率大于正反应速率,则改变条件为升高温度或增大压强;从开始改变条件平衡均向正反应进行,t4时平衡逆向移动,即表示平衡混合物中CO的含量最高的一段时间是t3~t4,
故答案为:升高温度或增大压强;t3~t4;
(4)在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,设转化的氮气为xmol,则
3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)
开始 2mol 0
转化 x 3x
平衡 2-x 3x
$\frac{(3x)^{6}}{(2-x)^{2}}$=729,解得x=1mol,
则N2的转化率是$\frac{1mol}{2mol}$×100%=50%,故答案为:50%.
点评 本题考查化学平衡的计算,为高频考点,把握平衡常数的含义、化学平衡移动因素及三段法计算是解答的关键,侧重分析与计算能力的考查,题目难度不大.

| A. | 水银 | B. | 青铜 | C. | 生铁 | D. | 碳素钢 |
| A. | 平衡向生成I2的方向移动 | B. | HI分子减少 | ||
| C. | I2的分子数增多 | D. | I2的浓度增大 |
| A. | ①④⑤ | B. | ②④⑤ | C. | ①②④ | D. | ①②③ |
| A. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| B. | 硫化钠水解:S2-+2H2O?H2S+2OH- | |
| C. | 往AgI悬浊液中滴加Na2S饱和溶液:2Ag+ (aq)+S2-(aq)=Ag2S(s) | |
| D. | 用醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ |
| A. | C2H6O | B. | C2H4 | C. | C | D. | C4H10 |
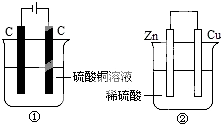 如图两个装置中,分别装有200mL对应的饱和溶液,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,分别装有200mL对应的饱和溶液,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | ②中负极:2H++2e-═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |
| A. | 能与溴水发生加成反应 | |
| B. | 能与氯化氢反应生成氯乙烯,继而制取聚氯乙烯 | |
| C. | 分子中的所有原子都处在一条直线上 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
为探讨反应X+Y Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间如右表所示.下列关于该反应反
Z中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间如右表所示.下列关于该反应反 应速率的判断正确的是( )
应速率的判断正确的是( )
c(X) | c(Y) | 所需时间(秒) |
0.10 | 0.10 | 0.60s |
0.20 | 0.10 | 0.15s |
0.20 | 0.05 | 0.30s |
A.与c(X)成正比且与c(Y)成正比
B.与c(X)成正比且与c(Y)无关
C.与c2(X)成正比且与c(Y)成正比
D.与c2(X)成正比且与c(Y)成反比