题目内容
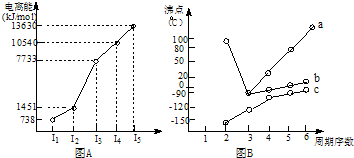
将某有机物样品3.0g通入足量的氧气后充分燃烧,在120℃条件下将燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g,然后将气体再通入足量的氢氧化钡溶液中,可得到沉淀19.7g(不考虑溶解的沉淀物),此时还有标准状况下的气体2.24L,该气体能用于抢救危重病人.实验测得该有机物蒸气的密度是相同条件下氦气的15倍.求该有机物的分子式和通入氧气的总体积(标准状况)?
答案:
解析:
解析:
解:w(C)=0.1mol×12g/mol÷3.0×100%=40%
w(H)=0.1mol×2×1g/mol÷3.0×100%=6.67%
w(O)=1-40%-6.67%=53.33%
每分子中:n(C)=60×40%÷12=2;n(H)=60×6.67%÷1=4;n(O)=60×53.33%÷16=2
所以分子式为:C2H4O2
通入氧气总体积:3.0g÷60g/mol×2×22.4l/mol=4.48L

练习册系列答案
相关题目
 有机物M(分子式:C6H4S4)是隐形飞机上吸波材料的主要成分.某化学兴趣小组为验证其组成元素,并探究其分子结构进行了下列实验:
有机物M(分子式:C6H4S4)是隐形飞机上吸波材料的主要成分.某化学兴趣小组为验证其组成元素,并探究其分子结构进行了下列实验:
