题目内容
(1)下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥食盐晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3•H2O,其中能够导电的是 ,强电解质是 ,弱电解质是 ,非电解质是 。
(2)H2S溶于水的电离方程式为 。
①向H2S溶液中加入NaOH溶液时,电离平衡向 移动,(填左或右)c(H+) ,c(S2-) 。 (填增大或减少或不变)
②向H2S溶液中加入Na2S固体时,电离平衡向 移动, (填左或右)
c(H+) ,c(S2-) 。(填增大或减少或不变)
(1) ①⑤⑦ ; ③⑤⑥ ; ⑨⑩ ; ②⑧ 。
(2) H2S H+ +HS- 、 HS-
H+ +HS- 、 HS- H++S2-
H++S2-
① 右 , 减小 , 增大 。
② 左 , 减小 , 增大
【解析】(1)可以导电的是石墨、熔融的硫酸钾、硫酸溶液,所以答案选①⑤⑦;在溶液中完全的电离的,不存在电离平衡的是强电解质,因此答案选③⑤⑥;在溶液中部分电离,存在电离平衡的是弱电解质,因此答案选⑨⑩;溶于水和熔融状态下不能电离出阴阳离子的化合物是非电解质,答案选②⑧。
(2)硫化氢是弱电解质,电离方程式是H2S H+ +HS- 、HS-
H+ +HS- 、HS- H++S2-。
H++S2-。
①向H2S溶液中加入NaOH溶液时,则中和氢离子,促进电离,即电离平衡向右移动,但氢离子浓度降低,硫离子浓度增大。
②向H2S溶液中加入Na2S固体时,则硫离子浓度增大,抑制电离,氢离子浓度降低。

 阅读快车系列答案
阅读快车系列答案 按要求填写下列空白.
按要求填写下列空白.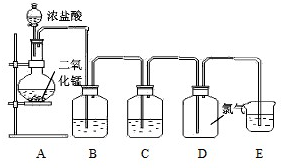
 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式: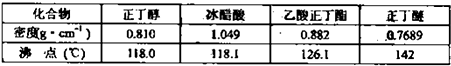

 ,其中氧化剂是 , 8.4g铁粉参加反应,转移电子 mol。
,其中氧化剂是 , 8.4g铁粉参加反应,转移电子 mol。 的方法是 。
的方法是 。