题目内容
相同条件下,0.1mol/L Na2S2O3溶液和0.1mol/L H2SO4溶液各5mL,与10mL水混合,反应时间为t1 s;0.2mol/L Na2S2O3溶液和0.2mol/L H2SO4溶液各5mL,与30mL水混合,反应时间为t2 s,则t1和t2的关系是(忽略体积变化)
| A.t1>t2 | B.t1<t2 | C.t1=t2 | D.不能肯定 |
C
解析试题分析:混合前,前者溶液的浓度是后者溶液浓度的1/2,但前者溶液的总体积也是后者溶液总体积的1/2,所以混合后的溶液的浓度是相等的,反应速率相同,反应的时间相同,答案选C。
考点:考查反应速率的比较

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
80℃时,2L密闭容器中充入0.40molN2O4,发生反应
N2O4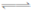 2NO2
2NO2 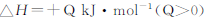 ,获得如下数据:
,获得如下数据: 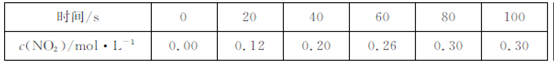 下列判断正确的是
下列判断正确的是
| A.升高温度该反应的平衡常数K减小 |
B.20~40s内,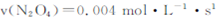 |
| C.反应达平衡时,吸收的热量为0.30QkJ |
| D.100s时再通入0.40molN2O4,达新平衡时N2O4的转化率增大 |
下列有关叙述正确的是( )
A.在一定条件下,反应CO(g)+2H2(g)  CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 |
| B.常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+ c(CH3COOH)=0.01mol/L |
| C.pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① |
| D.已知某温度下:Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)= 1×10-12,,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/LK2CrO4溶液,则先产生Ag2CrO4沉淀 |
某化学反应中,反应物B的物质的量浓度在20s内,从2.0mol/L变成了1.0mol/L,则这20s内B的反应速率为
A.0.05mol/(L s) s) | B.0.05 | C.0.5mol/(L s) s) | D.0.05mol/L |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,则下列说法正确的是 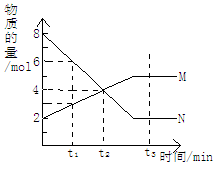
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
 CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( ) 2AB(g)达到反应限度的标志是
2AB(g)达到反应限度的标志是