题目内容
18.如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B,C,D,E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应.请回答下列问题: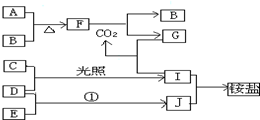
(1)写出化学式:CCl2 FNa2O2 JNH3;
(2)写出F的电子式
 ;
;(3)写出D和E反应的化学方程式:N2+3H2
 2NH3
2NH3(4)写出化合物G和I的溶液反应的离子方程式:2H++CO32-=CO2↑+H2O.
分析 化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na.G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐为NH4Cl,故C为Cl2,据此解答.
解答 解:化合物G的焰色反应为黄色,含有Na元素,F能与二氧化碳反应得到气体单质B与G,可推知F为Na2O2,B为O2,G为Na2CO3,而A与B(氧气)反应得到F(过氧化钠),则A为Na.G(Na2CO3)与I反应得到CO2,则I属于酸,I由气体非金属单质C与D在光照条件下得到,则I为HCl,C、D分别为H2、Cl2中的一种,I和J通常状况下呈气态,二者反应得到铵盐,且反应①是化工生产中的一种重要固氮反应,可推知J为NH3,D为H2,E为N2,铵盐为NH4Cl,故C为Cl2,
(1)根据上面的分析可知,C为Cl2,F为Na2O2,J为NH3,
故答案为:Cl2;Na2O2;NH3;
(2)F为Na2O2,F的电子式为 ,
,
故答案为: ;
;
(3)D为H2,E为N2,D和E反应的化学方程式为N2+3H2 2NH3,
2NH3,
故答案为:N2+3H2 2NH3;
2NH3;
(4)G为Na2CO3,I为HCl,G和I的溶液反应的离子方程式为2H++CO32-=CO2↑+H2O,
故答案为:2H++CO32-=CO2↑+H2O;
点评 本题考查无机物推断,涉及Na、Cl、N元素单质化合物性质,物质的状态、焰色反应及转化中特殊反应等是推断突破口,侧重基础知识的巩固,难度不大,注意中学常见化学工业.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | 干冰是分子晶体,则SiO2也是分子晶体 | |
| B. | 金属Na着火不能用干冰灭火,金属K着火也不能用干冰灭火 | |
| C. | SO2能使品红溶液褪色,CO2也能使品红溶液褪色 | |
| D. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 |
| A. | 将SO2通入KMnO4溶液中,溶液褪色,证明SO2具有漂白性 | |
| B. | 取样灼烧,可以鉴别某白色纺织品是棉织品还是羊毛制品 | |
| C. | 动物油中主要成分是不饱和高级脂肪酸甘油酯 | |
| D. | 取少量蔗糖溶液加稀硫酸,水浴加入几分钟后,再加入新制的氢氧化铜悬浊液并加热,观察现象,判断蔗糖水解产物中是否有葡萄糖 |
| A. | 减小C或D的浓度 | B. | 充入“惰性气体” | C. | 减小B的浓度 | D. | 升高温度 |
| A. | 和水中的杂质反应,生成沉淀 | |
| B. | Al3+和Fe3+都有吸附杂质使之沉淀的能力 | |
| C. | 使杂质变成泡沫而除去 | |
| D. | 生成氢氧化铝、氢氧化铁胶体,吸附水中杂质使之沉淀 |
 +HNO3(浓)$→_{55℃}^{浓硫酸}$
+HNO3(浓)$→_{55℃}^{浓硫酸}$ +H2O.
+H2O.