题目内容
【题目】固体D是一种红色氧化物. 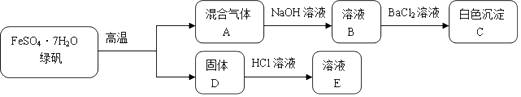
(1)混合气体A通入足量NaOH溶液后,溶液B中属于盐的溶质有 .
(2)白色沉淀C中加入盐酸的实验现象为 .
(3)固体D与HCl溶液反应的离子方程式为 .
【答案】
(1)Na2SO3;Na2SO4
(2)沉淀部分溶解且有气体生成
(3)Fe2O3+6H+=2Fe3++3H2O
【解析】解:FeSO47H2O高温分解得到固体D,固体D是一种红色氧化物为铁的氧化物判断为Fe2O3 , 溶于盐酸溶液得到E溶液为氯化铁溶液,混合气体A通入氢氧化钠溶液得到溶液B,加入氯化钡生成白色沉淀C为BaSO4 , 则A中含有SO3,结合盐酸化合价变化可知铁元素化合价升高,硫元素化合价降低,所以A气体中一定含有SO2 , 杯水沉淀中还有BaSO3 , (1)分析可知,混合气体A通入足量NaOH溶液后,溶液B中属于盐的溶质有硫酸钠和亚硫酸钠,化学式为:Na2SO3; Na2SO4 , 所以答案是:Na2SO3; Na2SO4;(2)白色沉淀C中加入盐酸,亚硫酸钡和盐酸溶解生成二氧化硫气体,反应的现象为沉淀部分溶解且有气体生成,
所以答案是:沉淀部分溶解且有气体生成;(3)固体D为氧化铁和盐酸反应生成氯化铁溶液,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
所以答案是:Fe2O3+6H+=2Fe3++3H2O.

练习册系列答案
相关题目