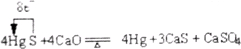题目内容
我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,1982年我国发行面值为10分的丹砂邮票。汞单质和化合物在工业生产和科学研究上有其广泛用途。丹砂炼汞的反应包括以下两个反应:反应Ⅰ HgS+O2![]() Hg+SO2
Hg+SO2
反应Ⅱ 4HgS+4CaO![]() 4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
请试完成下列问题:
(1)HgS与氧气反应,氧化剂是______________。
(2)请标出反应Ⅱ中电子转移的方向和数目:______________。
(3)得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式:__________________________________________。
(4)已知Hg(NO3)2溶液中加入Hg,存在如下平衡:Hg+Hg2+![]()
![]() ,提高
,提高![]() 浓度的方法是______________。
浓度的方法是______________。
(1)HgS和O2
(2)(双线桥表示也可) ![]()
(3)3Cu+8H++ 2![]()
![]() 3Cu2+ +2NO↑+4H2O
3Cu2+ +2NO↑+4H2O
(4)增大Hg2+浓度
解析:(4)考查点为外界条件对平衡移动的影响,观察Hg+Hg2+![]()
![]() 知,使
知,使![]() 浓度增大,只能是使用较大浓度的Hg(NO3)2溶液.
浓度增大,只能是使用较大浓度的Hg(NO3)2溶液.

练习册系列答案
相关题目
| |||||||||||||||||||