题目内容
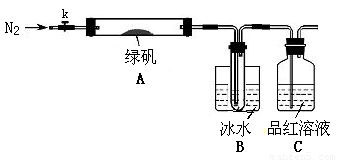
某学习小组拟通过实验探究某加碘食盐样品中碘元素的存在形式是IO3-而不是I-,并对该碘盐进行定量分析.
查阅资料知:
IO3-+5I-+6H+=3I2+3H2O
2IO3-+5HSO3-=I2+5SO42-+H2O+3H+
I2+2S2O32-=2I-+S4O62-
(1)设计实验方案,进行实验.在答卷上写出实验步骤、预期现象和结论.
限选试剂:稀硫酸、0.1mol/L AgNO3溶液、稀硝酸、1.0mol/L NaHSO3溶液、1.0mol/L KI溶液、新制氯水、1% 淀粉溶液、蒸馏水
(2)上述反应生成的I2可用四氯化碳检验.碘的四氯化碳溶液呈
(3)向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,可以回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式是
(4)该学习小组对该碘盐进行了定量分析:称取40.0g碘盐配成100mL溶液,取25.00mL该溶液于锥形瓶中,向锥形瓶中加入足量的碘化钾溶液,并加入1~2滴淀粉溶液,混合均匀后,逐滴加入物质的量浓度为0.001mol?L-1 Na2S2O3溶液15.00mL,恰好完全反应.
①滴定时Na2S2O3 溶液应放置于
②反应恰好完全依据的现象是
③该40.0g碘盐的含碘量为
查阅资料知:
IO3-+5I-+6H+=3I2+3H2O
2IO3-+5HSO3-=I2+5SO42-+H2O+3H+
I2+2S2O32-=2I-+S4O62-
(1)设计实验方案,进行实验.在答卷上写出实验步骤、预期现象和结论.
限选试剂:稀硫酸、0.1mol/L AgNO3溶液、稀硝酸、1.0mol/L NaHSO3溶液、1.0mol/L KI溶液、新制氯水、1% 淀粉溶液、蒸馏水
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, 加入几滴新制的氯水,再加入1~2滴1%淀粉溶液 加入几滴新制的氯水,再加入1~2滴1%淀粉溶液 充分振荡. |
溶液不呈蓝色,则溶液中无I-,碘元素的存在形式不是I-. |
| 步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, 加入几滴NaHSO3溶液,再加入1~2滴1%淀粉溶液 加入几滴NaHSO3溶液,再加入1~2滴1%淀粉溶液 充分振荡. |
溶液呈蓝色,则溶液中存在IO3-,碘元素的存在形式是IO3-. |
紫
紫
色.(3)向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,可以回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式是
I2+SO32-+H2O=2I-+SO42-+2H+
I2+SO32-+H2O=2I-+SO42-+2H+
.(4)该学习小组对该碘盐进行了定量分析:称取40.0g碘盐配成100mL溶液,取25.00mL该溶液于锥形瓶中,向锥形瓶中加入足量的碘化钾溶液,并加入1~2滴淀粉溶液,混合均匀后,逐滴加入物质的量浓度为0.001mol?L-1 Na2S2O3溶液15.00mL,恰好完全反应.
①滴定时Na2S2O3 溶液应放置于
碱式
碱式
滴定管中(填“酸式”或“碱式”).②反应恰好完全依据的现象是
溶液由蓝色恰好变为无色
溶液由蓝色恰好变为无色
.③该40.0g碘盐的含碘量为
1.0×10-5
1.0×10-5
mol.我国规定加碘食盐中碘的含量应在20~50mg/kg,该碘盐能
能
(填“能”或“不能”)达标.分析:(1)利用氯水氧化碘离子及碘单质遇淀粉变蓝检验碘离子;利用2IO3-+5HSO3-=I2+5SO42-+H2O+3H+及碘单质遇淀粉变蓝证明含IO3-;
(2)碘易溶于四氯化碳,呈紫色;
(3)Na2SO3将I2还原,生成碘离子和硫酸根离子;
(4)①Na2S2O3溶液显碱性;
②发生I2+2S2O32-=2I-+S4O62-,恰好反应时不存在碘单质;
③利用IO3-+5I-+6H+=3I2+3H2O、I2+2S2O32-=2I-+S4O62-,存在KIO3~3I2~6S2O32-,以此计算.
(2)碘易溶于四氯化碳,呈紫色;
(3)Na2SO3将I2还原,生成碘离子和硫酸根离子;
(4)①Na2S2O3溶液显碱性;
②发生I2+2S2O32-=2I-+S4O62-,恰好反应时不存在碘单质;
③利用IO3-+5I-+6H+=3I2+3H2O、I2+2S2O32-=2I-+S4O62-,存在KIO3~3I2~6S2O32-,以此计算.
解答:解:因氯水氧化碘离子及碘单质遇淀粉变蓝,则步骤1为加入几滴新制的氯水,再加入1~2滴1%淀粉溶液;
因2IO3-+5HSO3-=I2+5SO42-+H2O+3H+及碘单质遇淀粉变蓝证明含IO3-,则步骤2为加入几滴NaHSO3溶液,再加入1~2滴1%淀粉溶液,
故答案为:加入几滴新制的氯水,再加入1~2滴1%淀粉溶液;加入几滴NaHSO3溶液,再加入1~2滴1%淀粉溶液;
(2)碘易溶于四氯化碳,呈紫色,故答案为:紫;
(3)Na2SO3将I2还原,生成碘离子和硫酸根离子,该离子反应为I2+SO32-+H2O=2I-+SO42-+2H+,故答案为:I2+SO32-+H2O=2I-+SO42-+2H+;
(4)①Na2S2O3溶液显碱性,则应装在碱式滴定管中,故答案为:碱式;
②发生I2+2S2O32-=2I-+S4O62-,恰好反应时不存在碘单质,则滴定终点现象为溶液由蓝色恰好变为无色,故答案为:溶液由蓝色恰好变为无色;
③根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O、I2+2S2O32-=2I-+S4O62-,可知,存在KIO3~3I2~6S2O32-,则
I~KIO3~3I2~6S2O32-,
1 6
x 0.015L×1.0×10-3mol?L-1,
=
,解得x=2.5×10-6mol,
由40.0g碘盐配成100mL溶液,取25.00mL,原溶液中含I为2.5×10-6mol×4=1.0×10-5mol,
其含I质量为
=31.75mg/kg,含量应在20~50mg/kg,能达标,
故答案为:1.0×10-5;能.
因2IO3-+5HSO3-=I2+5SO42-+H2O+3H+及碘单质遇淀粉变蓝证明含IO3-,则步骤2为加入几滴NaHSO3溶液,再加入1~2滴1%淀粉溶液,
故答案为:加入几滴新制的氯水,再加入1~2滴1%淀粉溶液;加入几滴NaHSO3溶液,再加入1~2滴1%淀粉溶液;
(2)碘易溶于四氯化碳,呈紫色,故答案为:紫;
(3)Na2SO3将I2还原,生成碘离子和硫酸根离子,该离子反应为I2+SO32-+H2O=2I-+SO42-+2H+,故答案为:I2+SO32-+H2O=2I-+SO42-+2H+;
(4)①Na2S2O3溶液显碱性,则应装在碱式滴定管中,故答案为:碱式;
②发生I2+2S2O32-=2I-+S4O62-,恰好反应时不存在碘单质,则滴定终点现象为溶液由蓝色恰好变为无色,故答案为:溶液由蓝色恰好变为无色;
③根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O、I2+2S2O32-=2I-+S4O62-,可知,存在KIO3~3I2~6S2O32-,则
I~KIO3~3I2~6S2O32-,
1 6
x 0.015L×1.0×10-3mol?L-1,
| 1 |
| x |
| 6 |
| 0.015L×0.001mol/L |
由40.0g碘盐配成100mL溶液,取25.00mL,原溶液中含I为2.5×10-6mol×4=1.0×10-5mol,
其含I质量为
| 1×10-5×127×1000mg |
| 40×10-3kg |
故答案为:1.0×10-5;能.
点评:本题考查物质成分的探究及计算,把握发生的化学反应及离子检验为解答的关键侧重分析及计算能力的考查,注意是求食盐中碘的含量不是碘酸钾的含量,题目难度中等.

练习册系列答案
相关题目
 .
.
 .
.
 .
.