题目内容
固体化合物甲由两种短周期元素组成,可与水发生复分解反应,产生气体W.某实验兴趣小组用如图装置对固体甲的元素组成进行探究实验,实验中观察到如下现象:①产生的气体W能使C中试纸变蓝,②E中产生大量白烟.回答下列问题:
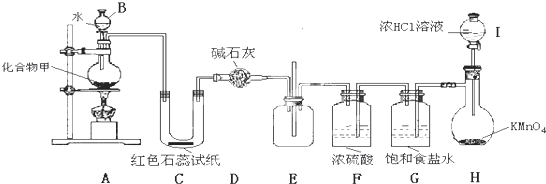
(1)仪器I的名称 .
(2)E中发生反应的化学方程式为 .
(3)装置G中饱和食盐水的作用是 .
(4)装置H中发生的反应,其氧化剂和还原剂的物质的量之比为 .
(5)2.5g化合物甲与水反应,理论上可得1.12L气体W(标准状况)则甲的化学式为 .
(6)若将装置C和D调换位置,则此时C中现象为 .
(7)该装置还存在着某些缺陷,请指出其中一点 .

(1)仪器I的名称
(2)E中发生反应的化学方程式为
(3)装置G中饱和食盐水的作用是
(4)装置H中发生的反应,其氧化剂和还原剂的物质的量之比为
(5)2.5g化合物甲与水反应,理论上可得1.12L气体W(标准状况)则甲的化学式为
(6)若将装置C和D调换位置,则此时C中现象为
(7)该装置还存在着某些缺陷,请指出其中一点
分析:(1)依据装置图中仪器和作用分析回答名称;
(2)A装置生成的氨气和H装置生成的氯气在E装置中反应生成氯化铵白色烟;
(3)反应生成的氯气中含有氯化氢气体通过饱和食盐水除去;
(4)依据高锰酸钾和浓盐酸反应生成氯气,氯化锰,水,依据氧化还原反应电子守恒分析计算;
(5)依据化学方程式结合元素化合价分析计算判断;
(6)装置C和D调换位置,生成的氨气被碱石灰吸收再通过石蕊试纸不变色;
(7)实验过程中生成的氨气和氯气都是污染气体,需要连接尾气吸收装置.
(2)A装置生成的氨气和H装置生成的氯气在E装置中反应生成氯化铵白色烟;
(3)反应生成的氯气中含有氯化氢气体通过饱和食盐水除去;
(4)依据高锰酸钾和浓盐酸反应生成氯气,氯化锰,水,依据氧化还原反应电子守恒分析计算;
(5)依据化学方程式结合元素化合价分析计算判断;
(6)装置C和D调换位置,生成的氨气被碱石灰吸收再通过石蕊试纸不变色;
(7)实验过程中生成的氨气和氯气都是污染气体,需要连接尾气吸收装置.
解答:解:(1)依据装置图中仪器和作用分析装置Ⅰ是分液漏斗,故答案为:分液漏斗;
(2)A装置生成的氨气和H装置生成的氯气在E装置中反应生成氯化铵白色烟,反应的化学方程式为:8NH3+3Cl2=N2+6NH4Cl,故答案为:8NH3+3Cl2=N2+6NH4Cl;
(3)反应生成的氯气中含有氯化氢气体通过饱和食盐水除去,故答案为:吸收氯气中的氯化氢气体;
(4)依据高锰酸钾和浓盐酸反应生成氯气,氯化锰,水,依据氧化还原反应电子守恒分析计算,氧化剂电子转移,KMnO4~Mn2+~5e-;还原剂电子转移,2HCl~Cl2~
2e-,电子守恒得到2KMnO4~10HCl,氧化剂和还原剂物质的量之比1:5,故答案为:1:5;
(5)依据化学方程式结合元素化合价分析计算判断,反应生成的氨气物质的量=
=0.05mol,设甲化学式为M3N2,反应的化学方程式为:
M3Nx+3xH2O=xNH3+3M(OH)x;
3M+14x x
2.5g 0.05mol
M=12x,
若x=1,M=12;
x=2,M=24;
x=3,M=36;
由上述分析可知,甲为Mg2N3,
故答案为:Mg2N3;
(6)装置C和D调换位置,生成的氨气被碱石灰吸收再通过石蕊试纸不变色,故答案为:红色石蕊试纸无现象;
(7)实验过程中生成的氨气和氯气都是污染气体,需要连接尾气吸收装置,故答案为:E中导气管连接尾气吸收装置.
(2)A装置生成的氨气和H装置生成的氯气在E装置中反应生成氯化铵白色烟,反应的化学方程式为:8NH3+3Cl2=N2+6NH4Cl,故答案为:8NH3+3Cl2=N2+6NH4Cl;
(3)反应生成的氯气中含有氯化氢气体通过饱和食盐水除去,故答案为:吸收氯气中的氯化氢气体;
(4)依据高锰酸钾和浓盐酸反应生成氯气,氯化锰,水,依据氧化还原反应电子守恒分析计算,氧化剂电子转移,KMnO4~Mn2+~5e-;还原剂电子转移,2HCl~Cl2~
2e-,电子守恒得到2KMnO4~10HCl,氧化剂和还原剂物质的量之比1:5,故答案为:1:5;
(5)依据化学方程式结合元素化合价分析计算判断,反应生成的氨气物质的量=
| 1.12L |
| 22.4L/mol |
M3Nx+3xH2O=xNH3+3M(OH)x;
3M+14x x
2.5g 0.05mol
M=12x,
若x=1,M=12;
x=2,M=24;
x=3,M=36;
由上述分析可知,甲为Mg2N3,
故答案为:Mg2N3;
(6)装置C和D调换位置,生成的氨气被碱石灰吸收再通过石蕊试纸不变色,故答案为:红色石蕊试纸无现象;
(7)实验过程中生成的氨气和氯气都是污染气体,需要连接尾气吸收装置,故答案为:E中导气管连接尾气吸收装置.
点评:本题考查了实验过程的分析,物质性质的判断,装置中试剂的选择和作用、实验现象的分析应用是解题关键,题目难度中等.

练习册系列答案
相关题目
下表给出了六种元素的相关信息,其中A、B、C、D、E、F为短周期元素,原子序数依次递增。
| 元素 | 相关信息 |
| A | 单质为密度最小的气体 |
| B | 元素最高正价与最低负价之和为0 |
| C | |
| D | 可形成D2、D3两种气态单质,其中一单质是保护地球地表环境的重要屏障 |
| E | 存在质量数为23,中子数为12的核素 |
| F | 单质F为淡黄色固体 |
根据上述信息填空:
(1)元素D在元素周期表中的位置是 。BD2由固态变为气态所需克服的微粒间作用力是 。
(2)化合物甲是一种强氧化剂,由元素D和E组成,写出一种甲的用途: ,
书写化合物甲与BD2的反应式并标出电子转移情况: 。
(3)化合物乙由元素D和F组成,气体乙与A2F反应的化学方程式是 。
化合物乙的危害 。(写一种)
(4)书写铜与C的高价含氧酸的稀溶液反应的离子方程式 。

