题目内容
14.对于反应2A(g)+B(g)?3C(g)+4D(g),下列数据是用不同物质的浓度变化表示的反应速率,其中反应进行得最快的是( )| A. | v(A)=30mol•L-1•min-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=48mol•L-1•min-1 | D. | v(D)=1mol•L-1•s-1 |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质的速率与其化学计量数比值越大,表示的反应速率越快,注意单位保持一致.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质的速率与其化学计量数比值越大,表示的反应速率越快.
A.$\frac{v(A)}{2}$=15mol•L-1•min-1;
B.v(B)=18mol•L-1•s-1=,$\frac{v(B)}{1}$=18mol•L-1•min-1;
C.$\frac{v(C)}{3}$=16mol•L-1•min-1;
D.v(D)=60mol•L-1•s-1,$\frac{v(D)}{4}$=15mol•L-1•min-1,
故选:B.
点评 本题考查化学反应速率快慢比较,利用比值法可以迅速判断,可以转化为同一物质表示的速率进行比较.

练习册系列答案
相关题目
7.下列各表述与示意图一致的是( )
| A. | 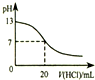 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 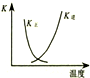 如图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 如图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 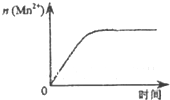 如图表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 如图表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 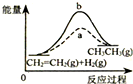 如图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 如图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
5.将8mL NO2和O2的混合气体通入倒立于水槽中装满水的量筒,充分反应后,剩余气体为1mL,则原混合气体中NO2和O2的体积比可能为( )
| A. | 7:5 | B. | 3:7 | C. | 7:1 | D. | 1:7 |
2.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 16 g O2和O3组成的混合气体中含有的原子数为 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
9.青蒿琥酯是治疗疟疾的首选药,可由青蒿素两步合成得到.下列有关说法正确的是 ( )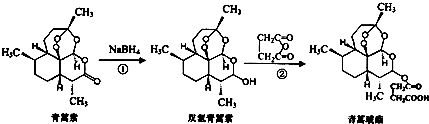

| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素不能与NaOH溶液反应 | |
| C. | 反应②原子利用率为100% | |
| D. | 青蒿琥酯能与氢氧化钠溶液反应可生成青蒿琥酯钠 |
19.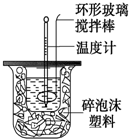 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)倒入NaOH溶液的正确操作是C
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后成溶液的比热容c=4.18J/(g•℃).利用上表数据计算该反应放出的热量为:1.4212kJ.
(4)利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度; c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)倒入NaOH溶液的正确操作是C
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
(4)利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度; c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
6.下列说法或做法正确的是( )
| A. | CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性大于碳酸 | |
| B. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| C. | 一块表面已被氧化为Na2O的钠块10.8g,将其投入100g水中,产生H2 0.2g,则被氧化的钠是4.6g | |
| D. | 生成一种单质和一种化合物的反应一定是置换反应 |

 .
.