题目内容
电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液
a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,则:
①电解池中X极上的电极反应式为________;
②Y电极上的电极反应式为________.
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________,电极反应式是________;
②Y电极的材料是________,电极反应式是________.
(说明:不必写出杂质发生的电极反应)
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.该电解槽的阳极反应式是________.

答案:
解析:
解析:
|
讲析:本题通过电解池的应用考查电解池电极反应式的书写,关键要明确电极反应中参与反应的是金属本身还是溶液中的离子放电. (1)由于电极材料是惰性电极,不参与电极反应,则书写电极反应式时只考虑溶液中的离子放电顺序即可.移向Y阳极的阴离子有Cl-和水电离出的OH-,但在阳极上放电的是Cl-;移向X阴极的阳离子有Na+和水电离出的H+,但在阴极上放电的是H+.所以上述电解池的电极反应为:阳极:2Cl--2e-点拨:电解池电极反应式书写主要掌握以下几点: (1)首先看阳极材料,如果阳极是活泼电极(金属活动顺序表Ag以前),则应是阳极失电子,阳极不断溶解,溶液中的阴离子不能失电子.(2)如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序书写书写电极反应式. |

练习册系列答案
相关题目

 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: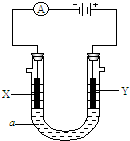 (I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
(I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2. 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连.