题目内容
试回答下列问题(温度均为25℃时):
(1)0.01mol/L的稀盐酸pH=
(2)1mLpH=12的NaOH溶液,加水稀释至100mL,稀释后的溶液中
=
(3)pH=13的Ba(OH)2溶液 a L与pH=3的H2SO4溶液b L混合.若所得混合溶液呈中性,则a:b=
(1)0.01mol/L的稀盐酸pH=
2
2
,其中由水电离出的c(H+)水=1×10-12
1×10-12
mol/L;(2)1mLpH=12的NaOH溶液,加水稀释至100mL,稀释后的溶液中
| c(H+) | c(OH-) |
1×10-6
1×10-6
;(3)pH=13的Ba(OH)2溶液 a L与pH=3的H2SO4溶液b L混合.若所得混合溶液呈中性,则a:b=
0.01
0.01
.分析:(1)根据PH=-lg(c(H+)计算PH,结合c(H+)×c(OH-)=10-14计算由水电离出的c(H+);
(2)根据溶液稀释前后溶质的物质的量浓度不变计算溶液中
;
(3)根据n(H+)=n(OH-)计算.
(2)根据溶液稀释前后溶质的物质的量浓度不变计算溶液中
| c(H+) |
| c(OH-) |
(3)根据n(H+)=n(OH-)计算.
解答:解:(1)PH=-lg(c(H+)=-lg(0.01)=2,由c(H+)×c(OH-)=10-14可知:c(OH-)=
mol/L=1×10-12mol/L,
故答案为:2; 1×10-12;
(2)1mLpH=12的NaOH溶液,加水稀释至100mL,稀释后的溶液中c(OH-)=1×10-10mol/L,c(H+)=1×10-4mol/L
则:
=1×10-6,故答案为:1×10-6;
(3)pH=13的Ba(OH)2溶液 a L与pH=3的H2SO4溶液b L混合.若所得混合溶液呈中性,则有n(H+)=n(OH-),
即:0.1mol/L×2×aL=0.001mol/L×2×bL,
则a:b=0.01,
故答案为:0.01.
| 10-14 |
| 0.01 |
故答案为:2; 1×10-12;
(2)1mLpH=12的NaOH溶液,加水稀释至100mL,稀释后的溶液中c(OH-)=1×10-10mol/L,c(H+)=1×10-4mol/L
则:
| c(H+) |
| c(OH-) |
(3)pH=13的Ba(OH)2溶液 a L与pH=3的H2SO4溶液b L混合.若所得混合溶液呈中性,则有n(H+)=n(OH-),
即:0.1mol/L×2×aL=0.001mol/L×2×bL,
则a:b=0.01,
故答案为:0.01.
点评:本题考查物质的量的相关计算,题目难度不大,注意相关计算公式的运用.

练习册系列答案
相关题目
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.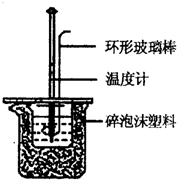 实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据: 在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)
在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g) =______;
=______;