题目内容
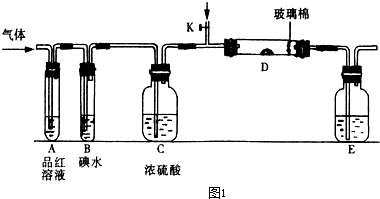
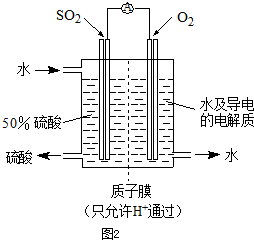
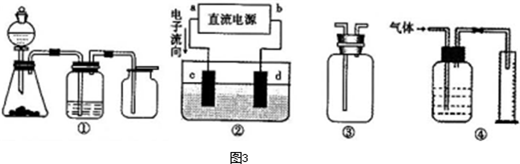
实验是化学研究的基础.下列关于各实验装置的叙述不正确的是( )

| A、装置①可用于乙醇与水的分离 | B、装置②所示实验可比较硫、碳、硅三种元素的非金属性强弱 | C、装置③,关闭弹簧夹,向长颈漏斗中注水后,长颈漏斗内水面高度保持不变能说明装置不漏气 | D、图④装置可用来称量一定质量的NaOH固体 |
分析:A.乙醇和水的沸点不同,可用蒸馏的方法分离;
B.根据对应最高价氧化物的水化物的酸性可比较非金属性强弱;
C.关闭弹簧夹,向长颈漏斗中注水后,如装置不漏气,则长颈漏斗内水面高度保持不变;
D.氢氧化钠应放在烧杯中称量.
B.根据对应最高价氧化物的水化物的酸性可比较非金属性强弱;
C.关闭弹簧夹,向长颈漏斗中注水后,如装置不漏气,则长颈漏斗内水面高度保持不变;
D.氢氧化钠应放在烧杯中称量.
解答:解:A.乙醇和水的沸点不同,可用蒸馏的方法分离,题中装置正确,可用于分离操作,故A正确;
B.硫酸的酸性比碳酸强,可观察到锥形瓶内有气泡生成,为二氧化碳气体,二氧化碳气体通入烧杯中,可观察到白色沉淀生成,说明有硅酸生成,可说明酸性硫酸大于碳酸大于硅酸,则可比较硫、碳、硅三种元素的非金属性强弱,故B正确;
C.关闭弹簧夹,向长颈漏斗中注水后,如装置不漏气,则长颈漏斗内水面高度保持不变,故C正确;
D.氢氧化钠具有吸水性,易于空气中二氧化碳反应而变质,应放在烧杯中称量,故D错误.
故选:D.
B.硫酸的酸性比碳酸强,可观察到锥形瓶内有气泡生成,为二氧化碳气体,二氧化碳气体通入烧杯中,可观察到白色沉淀生成,说明有硅酸生成,可说明酸性硫酸大于碳酸大于硅酸,则可比较硫、碳、硅三种元素的非金属性强弱,故B正确;
C.关闭弹簧夹,向长颈漏斗中注水后,如装置不漏气,则长颈漏斗内水面高度保持不变,故C正确;
D.氢氧化钠具有吸水性,易于空气中二氧化碳反应而变质,应放在烧杯中称量,故D错误.
故选:D.
点评:本题考查较为综合,涉及物质的分离、提纯、性质比较以及物质的称量和气密性的考查等问题,侧重于学生的分析能力和评价能力的考查,为高考常见题型,注意把握物质的性质的异同以及相关实验操作的原理、注意事项等,难度中等.

练习册系列答案
相关题目
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )


| A、装置①常用于分离沸点不同的液体混合物 | B、装置②用于吸收氨气,能够防止倒吸 | C、以NH4Cl为原料,装置③可制备少量NH3 | D、装置④a口进气可收集Cl2、NO等气 |
实验是化学研究的基础.对下列实验的现象描述正确的是( )
 |
 |
 |
 |
| ① | ② | ③ | ④ |
| A、实验①溶液褪色 |
| B、实验②溶液褪色 |
| C、实验③溶液中看到一条光亮的通路 |
| D、实验④饱和碳酸钠溶液下方出现油状液体 |
 (2012?济南一模)(1)实验是化学研究的基础,下列有关说法中,正确的是
(2012?济南一模)(1)实验是化学研究的基础,下列有关说法中,正确的是