题目内容
【题目】磷有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常为化工生产中的还原剂。完成下列填空:
(1)H3PO2是一元中强酸,写出其电离方程式:_______;请将NaH2PO2溶液中的各离子按浓度由大到小的顺序排列:__________。
(2)室温下0.1mol/L的NaH2PO2溶液和0.1mol/L的Na2CO3溶液,pH更大的是_______,其原因是__________。
(3)化学镀银,可利用H3PO2把溶液中的Ag+还原为银的反应,已知该反应中还原剂与氧化剂的物质的量之比为1:4,则氧化产物是_______(填化学式)。
(4)工业上可用白磷(P4)与Ba(OH)2溶液反应生成PH3和Ba(H2PO2)2。写出并配平该反应的化学方程式________,若反应中转移电子6NA,用去还原剂_____mol。再向Ba(H2PO2)2溶液中加入盐酸制备H3PO2,有人说应该用硫酸代替盐酸,请说明用硫酸代替盐酸的优点:_______。
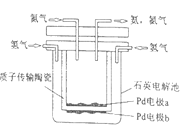
(5)下图是利用电解原理制备H3PO2的示意图(阳离子交换膜和阴离子交换膜分别只允许阳、阴离子通过;已知电极反应为:

阳极 4OH--4e→O2↑+ H2O
阴极 2H+ + 2e→H2↑):
分析在阳极室得到H3PO2原因:_______。
【答案】H3PO2![]() H++ H2PO2- Na+、H2PO2-、OH-、H+ Na2CO3 H3PO2是中强酸,碳酸是弱酸,CO32–的水解程度大于H2PO2- H3PO4 2P4+ 3Ba(OH)2+ 6H2O →2PH3↑+ Ba(H2PO2)2 1.5mol 用硫酸代替盐酸生成的硫酸钡是沉淀,易于与产物H3PO2分离(合理即得分) 阳极反应中消耗水电离的OH—,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品
H++ H2PO2- Na+、H2PO2-、OH-、H+ Na2CO3 H3PO2是中强酸,碳酸是弱酸,CO32–的水解程度大于H2PO2- H3PO4 2P4+ 3Ba(OH)2+ 6H2O →2PH3↑+ Ba(H2PO2)2 1.5mol 用硫酸代替盐酸生成的硫酸钡是沉淀,易于与产物H3PO2分离(合理即得分) 阳极反应中消耗水电离的OH—,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品
【解析】
![]() 根据
根据![]() 是一元中强酸可知,
是一元中强酸可知,![]() 是弱电解质,溶液中部分电离出氢离子,据此写出电离方程式;根据
是弱电解质,溶液中部分电离出氢离子,据此写出电离方程式;根据![]() 是一元中强酸,可以判断
是一元中强酸,可以判断![]() 为正盐,是强碱弱酸盐,水解显碱性;
为正盐,是强碱弱酸盐,水解显碱性;![]() 是一元中强酸,碳酸是弱酸,酸性越弱其对应盐的水解程度越大;
是一元中强酸,碳酸是弱酸,酸性越弱其对应盐的水解程度越大;![]() 和
和![]() 溶液反应进行化学镀银,此反应中氧化剂与还原剂的物质的量之比为4:1,结合化合价判断产物;
溶液反应进行化学镀银,此反应中氧化剂与还原剂的物质的量之比为4:1,结合化合价判断产物;![]() 根据反应物和生成物结合原子守恒和电子守恒书写方程式;
根据反应物和生成物结合原子守恒和电子守恒书写方程式;![]() 阳极反应中消耗水电离的
阳极反应中消耗水电离的![]() ,使
,使![]() 增大,
增大,![]() 通过阴离子交换膜进入阳极室,得到产品。
通过阴离子交换膜进入阳极室,得到产品。
![]() 是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为
是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为![]() ;由于
;由于![]() 是一元中强酸,所以
是一元中强酸,所以![]() 为一元强碱和一元中强酸形成的正盐,所以该盐溶液由于
为一元强碱和一元中强酸形成的正盐,所以该盐溶液由于![]() 发生水解成碱性,方程式为
发生水解成碱性,方程式为![]() ,所以溶液中离子浓度由大到小的顺序为
,所以溶液中离子浓度由大到小的顺序为![]() ;故答案为:
;故答案为:![]() ;
;![]() 是一元中强酸,碳酸是弱酸,酸性越弱其对应盐的水解程度越大,所以相同物质的量浓度的
是一元中强酸,碳酸是弱酸,酸性越弱其对应盐的水解程度越大,所以相同物质的量浓度的![]() 溶液的碱性比
溶液的碱性比![]() 溶液强,故答案为:
溶液强,故答案为:![]() ;
;![]() 是中强酸,碳酸是弱酸,
是中强酸,碳酸是弱酸,![]() 的水解程度大于
的水解程度大于![]() ;
;![]() 该反应中
该反应中![]() 为氧化剂,
为氧化剂,![]() 为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,
为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,![]() ,解得
,解得![]() ,所以氧化产物为
,所以氧化产物为![]() 价的
价的![]() ,故答案为:
,故答案为:![]() ;
;![]() 白磷
白磷![]() 与
与![]() 溶液反应生成
溶液反应生成![]() 气体和
气体和![]() ,反应方程式为
,反应方程式为![]() ,每生成
,每生成![]() 有6molP被氧化,即
有6molP被氧化,即![]() 被氧化,转移电子6mol;用硫酸代替盐酸生成的硫酸钡是沉淀,易于与产物
被氧化,转移电子6mol;用硫酸代替盐酸生成的硫酸钡是沉淀,易于与产物![]() 分离,故答案为:
分离,故答案为:![]() ;
;![]() ;用硫酸代替盐酸生成的硫酸钡是沉淀,易于与产物
;用硫酸代替盐酸生成的硫酸钡是沉淀,易于与产物![]() 分离;
分离;![]() 据电解反应式可知,阳极反应中消耗水电离的
据电解反应式可知,阳极反应中消耗水电离的![]() ,使
,使![]() 增大,
增大,![]() 通过阴离子交换膜进入阳极室,得到产品,故答案为:阳极反应中消耗水电离的
通过阴离子交换膜进入阳极室,得到产品,故答案为:阳极反应中消耗水电离的![]() ,使
,使![]() 增大,
增大,![]() 通过阴离子交换膜进入阳极室,得到产品。
通过阴离子交换膜进入阳极室,得到产品。

【题目】X、Y、Z、W四种物质的转化关系。下列组合中不符合该关系的是( )
X | Y | Z | W |
| |
A | Na2CO3 | CO2 | CaCO3 | Ca(HCO3)2 | |
B | SO2 | Na2SO3 | H2SO4 | NaHSO3 | |
C | HCl | FeCl2 | Cl2 | FeCl3 | |
D | Na2O2 | NaOH | Na2CO3 | NaHCO3 |
A.AB.BC.CD.D