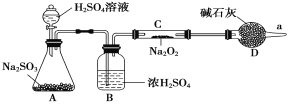
题目内容
【题目】(1)今有2H2+O2![]() 2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是 ________,电极反应式为__________________、_________________。
2H2O反应,构成燃料电池,则负极通的应是________,正极通的应是 ________,电极反应式为__________________、_________________。
(2)如把H2改为甲烷、H2SO4作导电物质,则电极反应式为:________、________。
【答案】H2 O2 2H2+4OH--4e-==4H2O O2+2H2O+4e-==4OH- CH4+2H2O-8e-==CO2+8H+ 2O2+8H++8e-===4H2O
【解析】
试题(1)负极失电子发生氧化反应,正极得电子发生还原反应;(2)负极是甲烷失电子发生氧化反应;正极是氧气得电子发生还原反应;
解析:(1)2H2+O2![]() 2H2O反应中,氢气发生氧化反应、氧气发生还原反应,原电池中负极失电子发生氧化反应,正极得电子发生还原反应,所以负极通的应是H2,负极反应式是2H2+4OH--4e-==4H2O,正极通的应是O2,正极反应式是O2+2H2O+4e-==4OH-;
2H2O反应中,氢气发生氧化反应、氧气发生还原反应,原电池中负极失电子发生氧化反应,正极得电子发生还原反应,所以负极通的应是H2,负极反应式是2H2+4OH--4e-==4H2O,正极通的应是O2,正极反应式是O2+2H2O+4e-==4OH-;
(2)负极是甲烷失电子发生氧化反应,负极反应式是CH4+2H2O-8e-==CO2+8H+;正极是氧气得电子发生还原反应,正极反应式是2O2+8H++8e-===4H2O。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目