题目内容
【题目】合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家F.Haber从1902年开始研究N2和H2直接合成NH3。在1.01×105Pa、250℃时,将1 molN2和1 molH2加入aL刚性容器中充分反应,测得NH3体积分数为0.04;其他条件不变,温度升高至450℃,测得NH3体积分数为0.025,则可判断合成氨反应为 ____填“吸热”或“放热”)反应。
(2)在1.01×105Pa、250℃时,将2 moIN2和2 molH2加入aL密闭容器中充分反应,H2平衡转化率可能为 ___(填标号)。
A =4% B <4% C 4%~7% D >11.5%
(3)我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18049纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
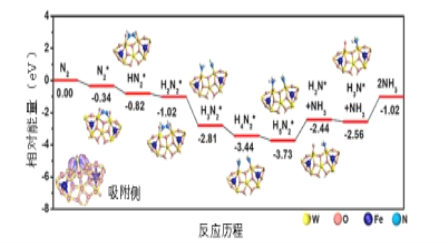
需要吸收能量最大的能垒(活化能)E=____ev,该步骤的化学方程式为____,若通入H2体积分数过大,可能造成 ___。
(4)T℃时,在恒温恒容的密闭条件下发生反应:![]() 反应过程中各物质浓度的变化曲线如图所示:
反应过程中各物质浓度的变化曲线如图所示:
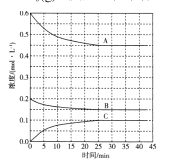
①表示N2浓度变化的曲线是 ____(填“A”、“B”或“C’,)。与(1)中的实验条件(1.01×105Pa、450℃)相比,改变的条件可能是_____。
②在0~25min内H2的平均反应速率为____。在该条件下反应的平衡常数为 ___mol-2.L2(保留两位有效数字)。
【答案】放热 D 1.54 NH3*+NH3=2NH3 占据催化剂活性位点过多 B 加压强或降温 0.006mol·L-1·min-1 0.73
【解析】
(1)升高温度,NH3体积分数降低;
(2)在1.01×105Pa、250℃时,将2 moIN2和2 molH2加入aL密闭容器中充分反应,与在1.01×105Pa、250℃时,将1 moIN2和1 molH2加入aL密闭容器中充分反应比,相当于加压;
(3)吸收能量最大的能垒,即相对能量的差最大;根据图示写方程式;
(4)根据反应方程式,N2、H2、NH3的变化量比为1:3:2;图氢气的转化率为25%,(1)中氢气的转化率是11.5%,根据转化率的变化分析;
②A表示氢气的浓度变化,根据![]() 计算H2的平均反应速率;根据
计算H2的平均反应速率;根据 计算平衡常数;
计算平衡常数;
(1)升高温度,NH3体积分数降低,说明升高温度平衡逆向移动,正反应放热;
(2)在1.01×105Pa、250℃时,将1 molN2和1 molH2加入aL刚性容器中充分反应,测得NH3体积分数为0.04;

![]()
![]() ,x=0.0384,H2平衡转化率
,x=0.0384,H2平衡转化率![]() ,在1.01×105Pa、250℃时,将2 moIN2和2 molH2,相当于加压,平衡正向移动,氢气转化率增大,H2平衡转化率>11.5%,故选D;
,在1.01×105Pa、250℃时,将2 moIN2和2 molH2,相当于加压,平衡正向移动,氢气转化率增大,H2平衡转化率>11.5%,故选D;
(3)根据图示,吸收能量最大的能垒,即相对能量的差最大是-1.02-(-2.56)=1.54;根据图示,该步的方程式是NH3*+NH3=2NH3;若通入H2体积分数过大,氢分子占据催化剂活性位点过多;
(4)①根据反应方程式,N2、H2、NH3的变化量比为1:3:2,所以表示N2浓度变化的曲线是B;(1)中氢气转化率11.5%,1:3时氢气转化率更低,图中氢气转化率25%,故只能考虑压强、温度的影响,可以采用加压或降温的方法;
②A表示氢气的浓度变化, ![]() 0.006mol·L-1·min-1;
0.006mol·L-1·min-1; mol-2.L2。
mol-2.L2。