题目内容
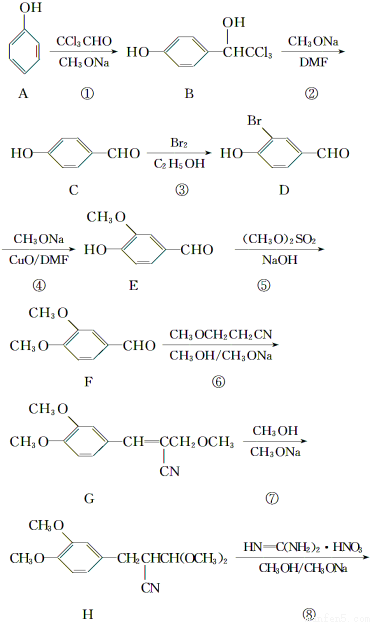
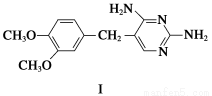
有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):
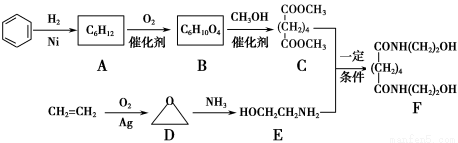
(1)B的结构简式是____________;E中含有的官能团名称是________。
(2)由C和E合成F的化学方程式是___________________________________________
(3)同时满足下列条件的苯的同分异构体的结构简式是________________。
①含有3个双键 ②核磁共振氢谱只显示1个吸收峰 ③不存在甲基
(4)乙烯在实验室可由______(填有机物名称)通过________(填反应类型)制备。
(5)下列说法正确的是________(填字母序号)。
a.A属于饱和烃 b.D与乙醛的分子式相同 c.E不能与盐酸反应 d.F可以发生酯化反应
(1)HOOC(CH2)4COOH 羟基、氨基

(3)
(4)乙醇 消去反应(其他合理答案均可)
(5)abd
【解析】根据合成路线图中已知物质的结构简式,推断出其他物质的结构简式,按照题目要求解答相关问题即可。(1)B和甲醇反应生成C,根据C的结构简式可以判断B为二元羧酸;E分子中有两种官能团:氨基和羟基。(2)观察C、E、F三者的结构简式,可知C和E反应即为E中的HOCH2CH2NH—取代了C中的—OCH3,同时生成两分子的甲醇。(3)苯的分子式为C6H6,离饱和烃还差8个氢原子,条件①该分子中存在3个双键,要满足碳、氢比,分子中还应存在一个环状结构;条件②说明该分子呈对称结构,分子中氢的位置是相同的;再结合条件③即可写出该物质的结构简式。(4)实验室中是利用浓硫酸和乙醇反应制取乙烯的,该反应类型为消去反应。(5)A是环己烷,属于饱和烃,所以a项正确;D的分子式为C2H4O,其分子式和乙醛的相同,所以b项正确;E分子中含有氨基,可以和盐酸反应,所以c项错误;F分子中含有羟基,可以和羧酸发生酯化反应,所以d项正确。

3,5?二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5?二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20 ℃) /g·cm-3 | 溶解性 |
甲醇 | 64.7 | — | 0.791 5 | 易溶于水 |
乙醚 | 34.5 | — | 0.713 8 | 微溶于水 |
3,5?二甲氧基苯酚 | — | 33~36 | — | 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是________________。②萃取用到的分液漏斗使用前需________并洗净,分液时有机层在分液漏斗的________(填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是________;用饱和食盐水洗涤的目的是________________________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是________(填字母)。
a.蒸馏除去乙醚 b.重结晶
c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先________,再________。
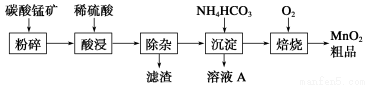
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是__________________。
(2)酸浸后的溶液中含有Mn2+、SO42—,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为__________________________。
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是
_____________________________________________________________。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去______________________。
(3)从溶液A中回收的主要物质是________________,该物质常用作化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式:______________________________。
工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)  2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 |
| 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。