题目内容
【题目】铁及其化合物在生产、生活中有广泛的应用。
(1)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s)===MnFe2O(4-x)(s)+x/2O2(g) ΔH1
②MnFe2O(4-x)(s)+xH2O(g)===MnFe2O4(s)+xH2(g) ΔH2
③2H2O(g)===2H2(g)+O2(g) ΔH3
则:ΔH3与ΔH1、ΔH2的关系为ΔH3=________。
(2)纳米铁是重要的储氢材料,可用下列反应制得:Fe(s)+5COFe(CO)5(g) ΔH<0。在1 L恒容密闭容器中加入足量铁粉和0.5 mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图1所示。

①T1________(填“>”或“<”)T2。
②T2温度下,上述反应的平衡常数K=________(结果不要求带单位)。
(3)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。
①工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式为____________________。制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液混合的操作为________________________。
②已知K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图所示。


向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为____________________________________。
(4)电解法可制得K2FeO4,装置如图所示。阳极的电极反应式为________。
【答案】2(ΔH1+ΔH2)/x > 8×103 3ClO-+2Fe3++10OH-===2FeO42-+3Cl-+5H2O 在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中 HFeO4-+OH-===FeO42-+H2O Fe-6e-+8OH-===FeO42-+4H2O
【解析】
(1)根据盖斯定律结合热化学方程式计算可得ΔH3与ΔH1、ΔH2的关系;
(2) ①该反应的正反应为放热反应,升高温度平衡向逆反应方向移动,CO的浓度增大,以此判断;
②根据图中数据,列出三段式,找出平衡浓度,根据K=![]() 计算;
计算;
(3)①ClO-与Fe3+反应生成FeO42-,ClO-被还原为Cl-,根据得失电子守恒和电荷守恒及原子守恒写出反应的离子方程式;
制备K2FeO4时,K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中;
②由图可知,pH=6时溶液主要存在HFeO4-,加入KOH溶液发生中和,以此写出该反应的离子方程式;
(4)铁是阳极失去6个电子生成FeO42-,据此书写阳极反应式。
(1) 已知:①MnFe2O4(s)===MnFe2O(4-x)(s)+x/2O2(g) ΔH1
②MnFe2O(4-x)(s)+xH2O(g)===MnFe2O4(s)+xH2(g) ΔH2
③2H2O(g)===2H2(g)+O2(g) ΔH3
由热化学方程式结合盖斯定律,将反应①![]() 2+②
2+②![]() 2可得2xH2O(g)===2xH2(g)+xO2(g) ΔH=
2可得2xH2O(g)===2xH2(g)+xO2(g) ΔH=
2(ΔH1+ΔH2),反应③![]() x可以得到相同的热化学方程式,则有ΔH3=2(ΔH1+ΔH2)/x。
x可以得到相同的热化学方程式,则有ΔH3=2(ΔH1+ΔH2)/x。
故答案为:2(ΔH1+ΔH2)/x;
(2) ①该反应的正反应为放热反应,升高温度平衡向逆反应方向移动,平衡时CO的浓度增大,由图可知,T2时CO平衡浓度小于T1时,则T1>T2。
②T2温度下,
Fe(s)+5CO![]() Fe(CO)5(g)
Fe(CO)5(g)
起始(mol/L) 0.5 0
转化(mol/L) 0.4 0.08
平衡(mol/L) 0.1 0.08
平衡常数K=![]() =
=![]() =8×103,
=8×103,
故答案为:> ;8×103;
(3)①ClO-与Fe3+反应生成FeO42-,ClO-被还原为Cl-,根据得失电子守恒和电荷守恒及原子守恒可得反应的离子方程式为3ClO-+2Fe3++10OH-===2FeO42-+3Cl-+5H2O;
制备K2FeO4时,K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中,具体操作为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中;
故答案为:3ClO-+2Fe3++10OH-===2FeO42-+3Cl-+5H2O;在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中;
②由图可知,pH=6时溶液主要存在HFeO4-,加入KOH溶液发生中和,反应的离子方程式为HFeO4-+OH-===FeO42-+H2O,
故答案为:HFeO4-+OH-===FeO42-+H2O;
(4)铁是阳极失去6个电子,因此阳极电极反应式为Fe-6e-+8OH-=FeO42-+4H2O,
故答案为:Fe-6e-+8OH-===FeO42-+4H2O。

【题目】下列是典型晶体的结构示意图,从①到⑥对应正确的是:
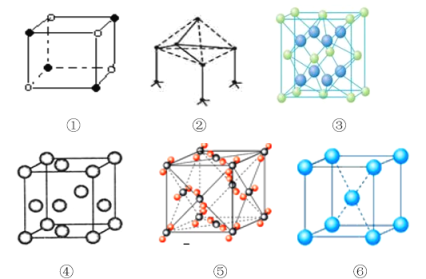
选项 | ① | ② | ③ | ④ | ⑤ | ⑥ |
A | NaCl | 单质硅 | CaF2 | Au | CO2 | K |
B | CaF2 | SiC | 金刚石 | Cu | CO2 | CsCl |
C | CsCl | 金刚石 | CaF2 | Cu | CO2 | Mg |
D | NaCl | BN | Au | CaF2 | CO2 | Na |
A. A B. B C. C D. D




