题目内容
【题目】铁与4mol·L-1的稀硫酸反应(放热反应)生成H2的物质的量与反应时间的关系如图所示。下列结论正确的是

A.反应开始2min内平均反应速率最大
B.常温下,改用98.3%的浓硫酸可以加快反应速率
C.反应在2~4min间生成H2的平均反应速率为0.1mol·L-1·min-1
D.2~4min内反应速率逐渐增大,说明2~4min内温度比浓度对反应速率的影响大
【答案】D
【解析】
A.在相同的时间间隔内,反应产生的H2的物质的量越多,反应速率就越大。根据图示数据可知在2~4min间反应速率最大,A错误;
B. 98.3%的浓硫酸中硫酸主要以H2SO4分子形式存在,H+浓度降低,Fe在室温下遇浓硫酸会发生钝化,所以常温下,改用98.3%的浓硫酸不能加快反应速率,B错误;
C.反应在2~4min间生成H2的物质的量是0.2mol,由于不能计算氢气的浓度,因此不能计算其反应速率,C错误;
D.在2~4min内反应速率大于0~2min内反应速率,说明2~4min内温度比浓度对反应速率的影响大,D正确;
故合理选项是D。

 阅读快车系列答案
阅读快车系列答案【题目】叠氮化钾(![]() )能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
)能促使作物或难于萌发的种子发育。设计如下实验制备叠氮化钾并测定其纯度:
I.制备
步骤1:制备亚硝酸丁酯(![]() )
)
![]()
反应装置如图1(夹持装置略去),向烧杯中依次加入稀硫酸、丁醇、亚硝酸钠溶液,待反应完全后,分离出上层油状物,用![]() 和
和![]() 的混合溶液洗涤三次,经干燥后备用。
的混合溶液洗涤三次,经干燥后备用。
步骤2:制备叠氮化钾
![]()
反应装置如图2(夹持及加热装置路去),向仪器A中加入![]() 乙醇溶液、
乙醇溶液、![]() 的联氨(
的联氨(![]() )、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于
)、亚硝酸丁酯,蒸汽浴加热,反应完全后,叠氮化钾即沉淀出来,冰浴冷却,过滤,先用无水乙醇洗涤,再用无水乙醚洗涤,在空气中于![]() 干燥。
干燥。


相关物质性质如下:
物质 | 颜色、状态 | 沸点(℃) | 溶解性 |
| 无色晶体 | 受热易分解 | 易溶于水,微溶于乙醇,不溶于乙醚 |
| 无色液休 | 118 | 微溶于水,与乙醇、乙醚混溶 |
| 无色或淡黄色油状液体 | 78 | 不溶于水,与乙醇、乙醚混溶 |
| 无色油状液体 | 118 | 与水、乙醇混溶,不溶于乙醚 |
请回答:
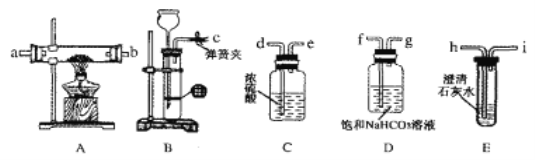
(1)仪器A的名称为_____________.
(2)步骤1中分离出亚硝酸丁酯的操作名称为_____________;步骤1中用NaCl和NaHCO3的混合溶液洗涤的目的是__________________________.
(3)步骤2中冰浴冷却的目的是__________________________;步骤2中干燥产品的温度控制在55~60℃,原因是__________________________
(4)如需提高产品的纯度,可在_____________(填编号)中进行重结晶。
A.无水乙醇 B.无水乙醚 C.水 D.乙醇的水溶液
Ⅱ.分光光度法测定产品的纯度
原理:![]() 与
与![]() 反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“
反应非常灵敏,生成红色络合物,在一定波长下测量红色溶液的吸光度,利用“![]() 吸光度”曲线确定样品溶液中的
吸光度”曲线确定样品溶液中的![]() 。测定步骤如下:
。测定步骤如下:
①用![]() 品体配制
品体配制![]() 标准溶液;
标准溶液;
②配制一组相同体积(![]() )不同浓度的
)不同浓度的![]() 标准溶液,分别加入
标准溶液,分别加入![]() (足量)
(足量)![]() 标准溶液,摇匀,测量吸光度,绘制标准溶液的
标准溶液,摇匀,测量吸光度,绘制标准溶液的![]() 与吸光度的关系曲线,如图;
与吸光度的关系曲线,如图;
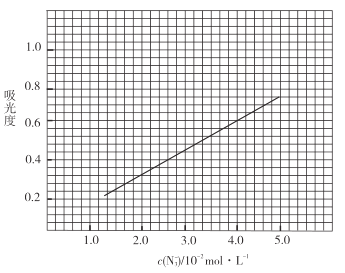
③产品测定:称取0.360g产品,配成![]() 溶液,取出
溶液,取出![]() 于标准管中,加入
于标准管中,加入![]() (足量)
(足量)![]() 标准溶液,摇匀,测得吸光度为0.6。
标准溶液,摇匀,测得吸光度为0.6。
(5)实验室用![]() 晶体配制
晶体配制![]() 标准溶液的方法为_________________.
标准溶液的方法为_________________.
(6)产品的纯度为_________________;若③中加入的![]() 标准溶液不足以将产品完全反应,则测得的产品纯度________________(填“偏高”“偏低”或“无影响”)。
标准溶液不足以将产品完全反应,则测得的产品纯度________________(填“偏高”“偏低”或“无影响”)。