题目内容
(2012?唐山二模)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
(1)已知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489kJ?mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则a=
(2)在T℃时,该反应的平衡常数K=64,在体积均为2L的恒容密闭容器甲和乙中,分别按下所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为
②下列说法正确的是
a.增加Fe2O3的量可以提高CO的转化率
b.甲、乙容器中CO的平衡转化率之比大于1
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.若容器内气体密度恒定时,标志反应达到平衡状态
(3)实验室有提纯后的铁矿粉(含氧化铁、氧化亚铁中的一种或两种),请设计实验探究其成分:
实验室仅提供如下仪器和试剂:烧杯、试管、玻璃棒、药匙、胶头滴管、酒精灯、试管夹;3mol/L H2SO4溶液、0.01mol/L KMnO4溶液、20% KSCN溶液、蒸馏水.
①提出合理假设:
假设1:只含氧化亚铁;
假设2:只含氧化铁;
假设3:
②请在下列表格中填写实验步骤、预期现象与结论.(可不必填满)
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
(1)已知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489kJ?mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则a=
-28.5
-28.5
kJ?mol-1,炼铁反应平衡常数K随温度升高而减小
减小
(填“增大”、“不变”或“减小”).(2)在T℃时,该反应的平衡常数K=64,在体积均为2L的恒容密闭容器甲和乙中,分别按下所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
60%
60%
.②下列说法正确的是
cd
cd
(填字母).a.增加Fe2O3的量可以提高CO的转化率
b.甲、乙容器中CO的平衡转化率之比大于1
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.若容器内气体密度恒定时,标志反应达到平衡状态
(3)实验室有提纯后的铁矿粉(含氧化铁、氧化亚铁中的一种或两种),请设计实验探究其成分:
实验室仅提供如下仪器和试剂:烧杯、试管、玻璃棒、药匙、胶头滴管、酒精灯、试管夹;3mol/L H2SO4溶液、0.01mol/L KMnO4溶液、20% KSCN溶液、蒸馏水.
①提出合理假设:
假设1:只含氧化亚铁;
假设2:只含氧化铁;
假设3:
既含氧化亚铁又含氧化铁
既含氧化亚铁又含氧化铁
.②请在下列表格中填写实验步骤、预期现象与结论.(可不必填满)
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品于烧杯中加适量稀硫酸溶解 | \ |
| 步骤2: 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 |
若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 |
| 步骤3: 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 |
若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 |
| 步骤4: 空 空 |
空 空 |
分析:(1)依据热化学方程式和盖斯定律计算得到需要的热化学方程式;计算分析炼铁反应是放热反应,温度升高平衡逆向进行,平衡常数K随温度升高而减小;
(2))①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率;
b.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率;
c.依据平衡三段式计算平衡物质的量;计算甲、乙容器中,CO的平衡浓度之比;
d.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态;
(3)①提纯后的铁矿粉含氧化铁、氧化亚铁中的一种或两种,以此分析判断;
②依据溶解后溶液中的铁离子和亚铁离子实验检验方法设计实验,依据反应现象判断样品成分.
(2))①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率;
b.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率;
c.依据平衡三段式计算平衡物质的量;计算甲、乙容器中,CO的平衡浓度之比;
d.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态;
(3)①提纯后的铁矿粉含氧化铁、氧化亚铁中的一种或两种,以此分析判断;
②依据溶解后溶液中的铁离子和亚铁离子实验检验方法设计实验,依据反应现象判断样品成分.
解答:解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489kJ?mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
由盖斯定律①-②×③得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJ?mol-1,
则炼铁反应是放热反应,温度升高平衡逆向进行,平衡常数K随温度升高而减小,
故答案为:-28.5;减小;
(2)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=
=
=64,解得x=0.6mol,
转化率=
×100%=60%,
故答案为:60%;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故a错误;
b.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,故b错误;
c.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3;故c正确;
d.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故d正确;
故答案为:cd;
(3)①提纯后的铁矿粉含氧化铁、氧化亚铁中的一种或两种,依据假设1和假设2可知,假设3既含氧化亚铁又含氧化铁,
故答案为:既含氧化亚铁又含氧化铁;
②样品溶解后的溶液,步骤2取少量溶液于试管中加入几滴硫氰酸钾溶液,若呈红色证明含有氧化铁,若不呈红色证明不含氧化铁;步骤3另取少量溶液与试管中加入高锰酸钾溶液若褪色证明含亚铁离子,若高锰酸钾溶液不褪色证明不含有亚铁离子,
故答案为:
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
由盖斯定律①-②×③得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJ?mol-1,
则炼铁反应是放热反应,温度升高平衡逆向进行,平衡常数K随温度升高而减小,
故答案为:-28.5;减小;
(2)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=
| c3(CO2) |
| c3(CO) |
| (1+x)3 |
| (1-x)3 |
转化率=
| 0.6mol |
| 1mol |
故答案为:60%;
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故a错误;
b.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,故b错误;
c.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4+0.6=2:3;故c正确;
d.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故d正确;
故答案为:cd;
(3)①提纯后的铁矿粉含氧化铁、氧化亚铁中的一种或两种,依据假设1和假设2可知,假设3既含氧化亚铁又含氧化铁,
故答案为:既含氧化亚铁又含氧化铁;
②样品溶解后的溶液,步骤2取少量溶液于试管中加入几滴硫氰酸钾溶液,若呈红色证明含有氧化铁,若不呈红色证明不含氧化铁;步骤3另取少量溶液与试管中加入高锰酸钾溶液若褪色证明含亚铁离子,若高锰酸钾溶液不褪色证明不含有亚铁离子,
故答案为:
| 实验操作 | 预期现象及结论 |
| 步骤2:取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 | 若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 |
| 步骤3:另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 | 若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 |
点评:本题考查了热化学方程式和盖斯定律计算应用,平衡常数计算应用,化学平衡三段式列式计算方法,原电池原理的分析判断,物质组成的实验探究实验方法,题目难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
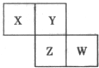 (2012?唐山二模)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
(2012?唐山二模)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )