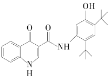
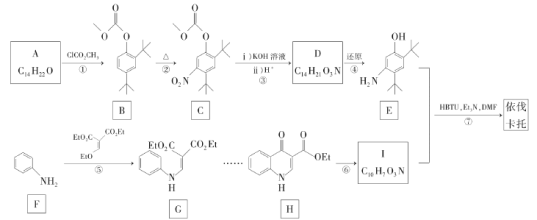
题目内容
【题目】已知实验室以乙醇为原料来制备乙酸乙酯时,经历了下面三步反应:
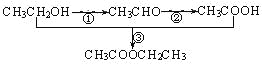
下列说法正确的是
A.乙醇和乙醛能发生氧化反应,乙酸和乙酸乙酯则不能被氧化
B.上述①、②、③的反应类型分别是氧化反应、加成反应和取代反应
C.上述乙醇、乙酸和乙酸乙酯都具有同分异构体
D.工业上可以通过石油分馏的方法获得乙醇
【答案】C
【解析】
A. 乙酸和乙酸乙酯可以燃烧被氧气氧化,A项错误;
B. ①、②、③的反应类型分别是氧化反应、氧化反应、取代反应(或酯化反应),B项错误;
C. 乙醇的同分异构体为甲醚,乙酸的同分异构体为甲酸甲酯等,乙酸乙酯的同分异构体有HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3CH2COOCH3等,所以都具有同分异构体,C项正确;
D. 工业上可以通过石油分馏的方法获得汽油、柴油、重油等,得不到乙醇,D项错误;
答案选C。

 金钥匙试卷系列答案
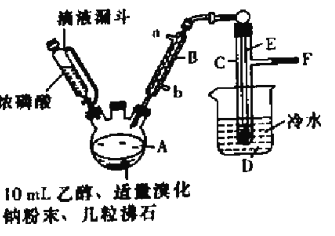
金钥匙试卷系列答案【题目】实验室用乙醇、浓磷酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置),反应原理为:H3PO4(浓)+NaBr![]() +NaH2PO4+HBr,CH3CH2OH+HBr
+NaH2PO4+HBr,CH3CH2OH+HBr![]() CH3CH2Br+H2O, 有关数据见下表:
CH3CH2Br+H2O, 有关数据见下表:
物质名称 | 乙醇 | 溴乙烷 | 溴 |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/gcm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中加入沸石的作用是______________________.
(2)仪器B的名称为____________,该仪器的进水口为_______(填“a”或“b”)口.
(3)实验中用滴液漏斗代替分液漏斗的优点为_________________
(4)制取氢溴酸时,为什么不能用浓H2SO4代替浓磷酸?_________(用化学方程式表示).
(5)将C中的馏出液转入锥形瓶中,边振荡边逐滴滴入浓H2SO4以除去水等杂质,滴加浓硫酸约1~2mL,使溶液明显分层,再用分液漏斗分去硫酸层,将经硫酸处理后的溴乙烷转入蒸馏瓶,水浴加热蒸馏,收集到35~40℃馏分约10.0g,从乙醇的角度考虑,本实验所得溴乙烷的产率是______(保留三位有效数字)
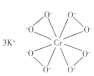
【题目】马日夫盐![]() 用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为
用于钢铁制品,特别是大型机械设备的磷化处理,可起到防锈效果。以软锰矿(主要成分为![]() 及少量的FeO、
及少量的FeO、![]() 和
和![]() )为原料制备马日夫盐的主要工艺流程如图:
)为原料制备马日夫盐的主要工艺流程如图:
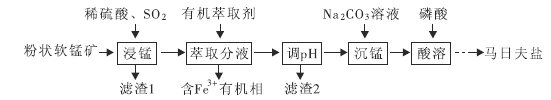
(1)“浸锰”过程中,FeO参与氧化还原反应的离子方程式为_______________。
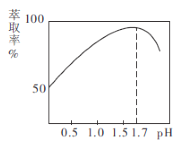
(2)![]() 的萃取率与溶液的pH的关系如图所示,当
的萃取率与溶液的pH的关系如图所示,当![]() 时,
时,![]() 的萃取率急剧下降的原因可能为_______________(用化学用语表示)。
的萃取率急剧下降的原因可能为_______________(用化学用语表示)。
(3)“调pH”的最大范围为________。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| l. 8 | 3.2 |
| 3.0 | 5.0 |
| 5.8 | 8.8 |
| 7.8 | 9.8 |
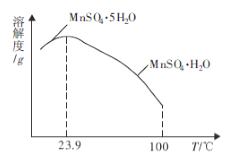
(4)如图为硫酸锰水合物的溶解度曲线,若要用“调pH”所得滤液制备![]() ,需要控制温度在80℃~90℃之间的原因是_____,采用水浴加热,经蒸发浓缩、_____(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。
,需要控制温度在80℃~90℃之间的原因是_____,采用水浴加热,经蒸发浓缩、_____(填操作名称)、用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥获得。
(5)写出检验“沉锰”是否已完成的实验操作_________。
(6)常温下,马日夫盐溶液显________性(填“酸”或“碱”),理由是:____________。(写出计算过程并结合必要的文字说明。已知:![]() 的电离常数
的电离常数![]() ,
,![]() ,
,![]() )
)
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=________kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=_________kJ.mol-1
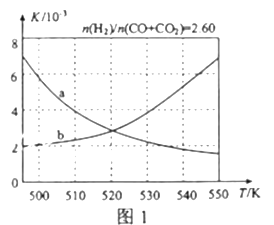
(2)反应①的化学平衡常数K的表达式为_____________;图1中能正确反映平衡常数K随温度变化关系的曲线为______(填曲线标记字母),其判断理由是__________________。
 .
.