题目内容
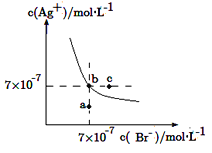
【题目】I2在KI溶液中存在平衡I2(aq)+I(aq)=I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上的任何点都表示平衡状态)。下列说法正确的是
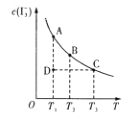
①I2(aq)+I—(aq)=I3—(ag) ΔH>0
②若温度为T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
③若反应进行到状态D时,一定有v正>v逆
④状态A与状态B相比,状态A的c(I2)大
⑤保持温度不变,向该混合溶液中加水,![]() 将变大
将变大
A. 只有①②B. 只有②③C. ①③④D. ①③⑤
【答案】B
【解析】
①由图象曲线的变化趋势可以知道,当温度升高时,I3-的物质的量浓度减小,说明升高温度平衡逆向移动,则该反应的正反应为放热反应,△H<0,故不符合题意;
②升高温度,平衡向逆反应方向移动,温度越高平衡常数越小、温度为T1<T2,反应的平衡常数分别为K1、K2,则K1>K2,故符合题意;
③若反应进行到状态D时,反应未达到平衡状态,若反应趋向于平衡,则反应向生成I3-的方向移动,则v正>v逆,故符合题意;
④温度升高,平衡向逆方向移动,c(I3-)变小,则c(I2)应变大,所以状态B的c(I2)大,故不符合题意;
⑤![]() ,在该混合液中加水,c(I-)降低,温度不变平衡常数不变,则
,在该混合液中加水,c(I-)降低,温度不变平衡常数不变,则![]() 减小,故不符合题意;
减小,故不符合题意;
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】根据要求回答下列有关问题。
(1)甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___。
(2)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=__,温度升高后,K值__(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=__,温度升高后,K值__(填“增大”、“不变”或“减小”)。
(3)在T℃时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为___。
②下列情况标志反应达到平衡状态的是__(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
d.容器内气体的平均相对分子质量保持不变
【题目】(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=________ mol·L-1;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=_________ mol·L-1。
(2)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到白色沉淀生成。将此混合液过滤,向滤渣中加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________, 反应的离子方程式为______________________。
(3)下列说法不正确的是_____________。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比![]() 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
(4)25 ℃,两种常见酸的电离常数如下表所示。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①![]() 的电离常数表达式 K =_____________。
的电离常数表达式 K =_____________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________。
【题目】完成下列问题:
(1)25℃时有下列4种溶液:
A.0.01mol/L氨水 B.0.01mol/LNaOH溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
请回答下列问题:
①上述4种溶液中,水的电离程度最大的是________(填序号)。
②若将B、C溶液等体积混合,所得溶液pH_______7(填“>”、“<”或“=”)
(2)已知25℃时
物质 | H3PO2 | H2S | 一元酸HA |
Ka | Ka=5.9×10-2 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=1.1×10-10 |
①一元酸H3PO2的电离方程式为_________________________。
②H2S溶液与NaA溶液反应的化学方程式为________________。
③经测定,25℃时0.01mol/LNa2S溶液的pH为11,则c(H+)+c(HS-)+2c(H2S)=______。
④0.1mol/L的NaHS溶液,测得溶液显_______。则该溶液中c(H2S)____c(S2-)(填“>”、“<”或“=”),作出上述判断的依据是__________(用计算和文字解释)。
(3)①25℃时,亚硝酸的电离常数为Ka=1.0×10-5,0.2mol/L的HNO2溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HNO2分子浓度由大到小的顺序为_____________。
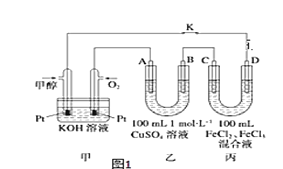
(4)如图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。
①甲中负极的电极反应式____________________。
②乙中B极的电极反应式____________________。
③丙中C极的电极反应式___________________。
【题目】下列实验操作、对应的现象以及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 往1mL 0.1mol/L AgNO3溶液中滴入2滴0.1 mol/L 的NaCl溶液,再往混合溶液中滴入2滴0.1 mol/L KI溶液,充分振荡 | 先产生白色沉淀,后出现黄色沉淀 | Ksp(AgCl) >Ksp (AgI) |
B | 一定条件下,密闭容器反应达平衡: H2(g)+I2(g) | 气体颜色加深 | 平衡逆移 |
C | 等体积、等pH的HA和HB两种酸溶液分别与足量的大小相同的锌反应 | 反应开始后HA产生H2的速率更快 | HA是弱酸 |
D | 向锌粒与稀硫酸反应的试管中滴加几滴CuSO4溶液 | 产生气体的速率明显加快 | CuSO4对该反应有催化作用 |
A.AB.BC.CD.D