题目内容
工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:C+O2→CO2 ①, CaCO3→CO2↑+CaO ②
53.含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为_________________m3。
54.纯净的CaCO3和焦炭按①②完全反应,当窑内配比率![]()
![]() =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
55.某次窑气成分如下:O2 0.2%,CO 0.2%,CO2 41.6%,其余为N2。则此次窑内配比率![]() 为何值?
为何值?
53.425.6(2分);
54.设n(C)=1mol mol,n(CaCO3)=2.2 mol,当空气O2中与C完全反应生成CO2时,所得窑气中CO2体积分数最大。
C + O2 → CO2 CaCO3→CO2↑+CaO
1 1 1 2.2 2.2
CO2体积分数=![]() ×100%=44.4%(3分);
×100%=44.4%(3分);
55.设窑气为100mol,则n(N2)=100-41.6-0.2-0.2=58mol,总共有n(O2)=58/4=14.5mol;故参加反应的n(O2)=14.5mol-0.2mol=14.3mol;
2C + O2 → 2CO C + O2 → CO2 CaCO3→CO2↑+CaO
2 1 2 1 1 1 1 1
0.2 0.1 0.2 14.2 14.2 14.2 27.4 27.4
n(CaCO3)=27.4mol;n(C)=14.4mol;
∴![]() =1.90(4分);
=1.90(4分);

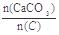 =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同) 为何值?
为何值? =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)