题目内容
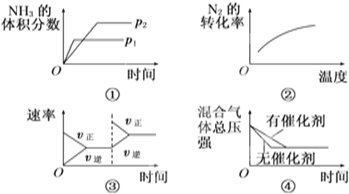
对可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,下列图象正确的是( )
分析:A、压强增大反应速率增大,平衡向气体体积减小的方向移动,氨气的体积分数增大;
B、升高温度平衡向逆反应方向移动,氮气的转化率降低;
C、增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应方向移动;
D、催化剂同等程度增大反应速率,不改变化学平衡,缩短到达平衡的时间.
B、升高温度平衡向逆反应方向移动,氮气的转化率降低;
C、增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应方向移动;
D、催化剂同等程度增大反应速率,不改变化学平衡,缩短到达平衡的时间.
解答:解:A、压强增大反应速率增大,先到达平衡,故压强P2>P1,增大压强平衡向气体体积减小的方向移动进行,氨气的体积分数增大,图象与实际不相符,故A错误;
B、升高温度平衡向逆反应方向移动,氮气的转化率降低,图象中温度越高氮气的转化率越大,与实际不相符,故B错误;
C、增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应方向移动,图象与实际相符合,故C正确;
D、催化剂同等程度增大反应速率,不改变化学平衡,缩短到达平衡的时间,图象中没有使用催化剂到达平衡的时间短,与实际不符,故D错误,
故选C.
B、升高温度平衡向逆反应方向移动,氮气的转化率降低,图象中温度越高氮气的转化率越大,与实际不相符,故B错误;
C、增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应方向移动,图象与实际相符合,故C正确;
D、催化剂同等程度增大反应速率,不改变化学平衡,缩短到达平衡的时间,图象中没有使用催化剂到达平衡的时间短,与实际不符,故D错误,
故选C.
点评:本题考查化学平衡图象分析判断,主要是平衡影响因素的分析判断,正确理解平衡移动原理是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对于可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,下列各项对示意图的解释与图象相符的是( )

| A、①压强对反应的影响(p2>p1) | B、②温度对反应的影响 | C、③平衡体系增加N2对反应的影响 | D、④催化剂对反应的影响 |
 2NH3(g),△H=-92.4 kJ.mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ.mol-1下列叙述正确的是


