题目内容
对于锌、铜和稀硫酸组成的原电池。Zn是________极(填正或负),发生的反应类型为________(填氧化或还原)反应, ________片(填锌、铜)上有气泡产生,该气体是________(填氢气、氧气) , 电子由________片通过导线流向________片(填锌、铜),溶液中的H+移向________极(填正或负),溶液中的H+浓度________(填增大、不变或减小 ),该装置能将________能转变为________能。
负 氧化 铜 氢气 锌 铜 正 减小 化学 电
考查原电池的概念及有关判断。在原电池中较活泼的金属作负极失去电子,被氧化,发生氧化反应。不活泼的金属作正极,负极所失去的电子经导线传递到正极上,所以溶液中的阳离子向正极移动,在正极上得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极。
考查原电池的概念及有关判断。在原电池中较活泼的金属作负极失去电子,被氧化,发生氧化反应。不活泼的金属作正极,负极所失去的电子经导线传递到正极上,所以溶液中的阳离子向正极移动,在正极上得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极。

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( ) 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是( )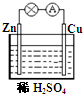 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )