题目内容
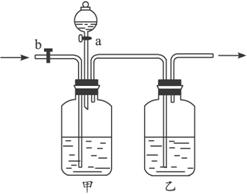
 将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生如下反应:2A(g)+2B(g)?3C(g);△H<0.下列说法不正确的是( )
将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生如下反应:2A(g)+2B(g)?3C(g);△H<0.下列说法不正确的是( )| A、在相同条件下两容器内的反应均达到化学平衡状态,升温时甲、乙两容器中反应速率均增大 | B、在相同条件下两容器内的反应均达到化学平衡状态,升温时甲乙两容器中的平衡均向逆方向移动 | C、在相同温度下,甲容器中加入2molA和2molB,乙容器中加入3molC,若甲容器经30s达到平衡状态,则乙容器达到平衡时所需要的时间也是30s | D、在相同的温度和压强下,用甲容器分别进行反应.第一次加入2molA和2molB;第二次加入2molA.2molB和3molC;第三次加入4molC.分别达到化学平衡状态时,C的物质的量百分含量分别为X、Y、Z.则X、Y、Z的大小关系是X=Y=Z |
分析:A.升高温度反应速率加快;
B.升高温度平衡向吸热反应方向移动;
C.甲容器随反应进行体积减小,所到达的平衡相当于将乙增大压强,压强越大反应速率越快;
D.甲为恒温恒压容器,将第二、三次按化学计量数转化都左边,A、B的物质的量之比为1:1与第一次相等,三次为等效平衡.
B.升高温度平衡向吸热反应方向移动;
C.甲容器随反应进行体积减小,所到达的平衡相当于将乙增大压强,压强越大反应速率越快;
D.甲为恒温恒压容器,将第二、三次按化学计量数转化都左边,A、B的物质的量之比为1:1与第一次相等,三次为等效平衡.
解答:解:A.升高温度,活化分子数目都增大,两容器反应速率都加快,故A正确;
B.两容器内都从A、B开始建立平衡,正反应为放热反应,升高温度平衡都向逆反应方向移动,故B正确;
C.甲容器随反应进行体积减小,相当于将乙增大压强,所以反应速率快,达到平衡时所需要的时间短,故C错误;
D.甲为恒温恒压容器,将第二、三次按化学计量数转化都左边,A、B的物质的量之比都是为1:1与第一次相等,三次为等效平衡,平衡时C的物质的量百分含量不变,则X=Y=Z,故D正确,
故选C.
B.两容器内都从A、B开始建立平衡,正反应为放热反应,升高温度平衡都向逆反应方向移动,故B正确;
C.甲容器随反应进行体积减小,相当于将乙增大压强,所以反应速率快,达到平衡时所需要的时间短,故C错误;
D.甲为恒温恒压容器,将第二、三次按化学计量数转化都左边,A、B的物质的量之比都是为1:1与第一次相等,三次为等效平衡,平衡时C的物质的量百分含量不变,则X=Y=Z,故D正确,
故选C.
点评:本题考查化学反应速率与化学平衡影响因素、等效平衡等,难度中等,C选项为易错点,关键是利用等效思想构建平衡建立的途径,D选项注意理解等效平衡规律.

练习册系列答案
相关题目