题目内容
【题目】某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: .
(2)实验结果表明,催化剂的催化效果与有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A,B,C三点所表示的反应速率最慢的是 . 
【答案】
(1)2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
(2)催化剂的表面积
(3)C
【解析】解:(1)上述实验中发生反应的化学方程式为2H2O2 ![]() 2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑,故答案为:2H2O2 ![]() 2H2O+O2↑;(2)时间少,则反应速率快,则实验结果表明,催化剂的催化效果与催化剂的表面积有关,故答案为:催化剂的表面积; (3)由图可知,曲线斜率变小,反应速率减小,则A、B、C三点所表示的反应速率最慢的是C,故答案为:C. (1)过氧化氢分解生成水和氧气;(2)时间少,则反应速率快;(3)由图可知,曲线斜率变小,反应速率减小.
2H2O+O2↑;(2)时间少,则反应速率快,则实验结果表明,催化剂的催化效果与催化剂的表面积有关,故答案为:催化剂的表面积; (3)由图可知,曲线斜率变小,反应速率减小,则A、B、C三点所表示的反应速率最慢的是C,故答案为:C. (1)过氧化氢分解生成水和氧气;(2)时间少,则反应速率快;(3)由图可知,曲线斜率变小,反应速率减小.

【题目】下表为元素周期表的一部分,请参照元素①﹣⑨在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)写出⑧的原子结构示意图 .
(2)④、⑤、⑥的原子半径由大到小的顺序为(用元素符号回答).
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(用化学式回答).
(4)②与④形成的原子个数比为1:2化合物的电子式为 .
(5)⑥的单质与①、④、⑤三种元素形成化合物的水溶液反应的离子方程式为: .
(6)②的最高价氧化物的熔沸点低于⑦的最高价氧化物的熔沸点,原因是 .
(7)⑤元素与⑨元素形成的化合物中,化学键类型为 , 高温灼烧该化合物时,火焰呈色.
(8)在②、③、⑦、⑧单质中,符合下列转化关系的是:(填元素符号).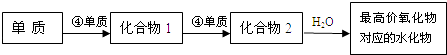
【题目】N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) ![]() 4NO2(g) + O2(g) △H =+Q kJ/mol (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g) + O2(g) △H =+Q kJ/mol (Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 5.0 | 3.5 | 2.5 | 2.5 |
下列说法正确的是
A. 500s内N2O5分解速率为6×10-3mol/(L·s)
B. 该温度下的平衡常数K =125
C. 反应达平衡时,吸收的热量为5Q kJ
D. 其他条件不变,若开始时c(N2O5)=10mol/L,则达平衡后c(N2O5)=5mol/L